
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该反应历程示意如下:

下列说法不正确的是
A.该反应遵循质量守恒定律
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②吸收能量并形成了C—C键
D.生成CH3COOH总反应的原子利用率为100%
科目:高中化学 来源: 题型:
【题目】钛被誉为“21世纪的金属”,在工农业生产、医疗、国防、科技等方面中有着极其广泛而重要的用途。四氯化钛是工业上制备金属钛的重要原料。在常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4的反应原理为:TiO2+2C+2Cl2![]() =TiCl4+2CO。
=TiCl4+2CO。
下图是实验室模拟工业生产制备四氯化钛的反应装置,其主要操作步骤有(顺序己打乱):
①连接好整套装置,并检査装置的气密性;
②当锥形瓶中的TiCl4的量不再增加时,停止加热,改通CO2气体直至电炉中的瓷管冷却为止;
③将Ti02、炭粉混合均匀后,装入管式电炉中;
④将电炉升温至800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水;
⑤通入干燥的CO2气体并持续一段时间。

试回答:
(1)仪器F的名称是_______________,装罝A所用的试剂名称是_______________。
(2)正确的操作程序是(填写操作步骤的序号)______________________________。
(3)操作⑤的目的是______________________________。
(4)装置中冷凝管进水口的位置是(填a或b)_______________,装置E的作用_______________。
(5)将少量TiCl4露置于空气中,可能看到的现象是______________________________。
(6)利用化合物TiCl4可制备TiO2,请结合化学用语解释该过程:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用于验证气体的某些化学性质,所得现象和结论均正确的是
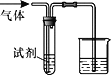
气体 | 试剂 | 现象 | 结论 | |
A | CH2=CH2 | 溴水 | 溶液褪色 | C2H4能与Br2发生取代反应 |
B | CO2 | BaCl2溶液 | 产生白色沉淀 | CO2能与可溶性钡盐反应 |
C | Cl2 | FeCl2溶液 | 溶液变为棕黄色 | 氧化性Cl2>Fe3+ |
D | SO2 | KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质或结构中,由相同种类元素组成的是( )
A. 胆固醇、脂肪酸、脂肪酶
B. DNA、RNA、磷脂
C. 氨基酸、核苷酸、核酸
D. 性激素、纤维素、胰岛素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的过程如下:
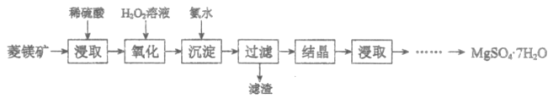
(1)MgCO3溶于稀硫酸的离子方程式是___________。
(2)“氧化”步骤中,加入H2O2溶液的目的是___________(用离子方程式表示)。
(3)“沉淀”步骤中,用氨水调节溶液pH的范围是___________。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
(4)“过滤”所得滤液中含有的阳离子是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:

(1)碳原子价层电子的轨道表达式为__________,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是_________。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是____________。
(4)EMIM+离子中,碳原子的杂化轨道类型为______。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则EMIM+离子中的大π键应表示为________。
),则EMIM+离子中的大π键应表示为________。

(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______晶体,其中硼原子的配位数为_______。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为________(列出化简后的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A.a点时溶液中阳离子仅为Cu2+和Fe2+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com