
【题目】如图装置可用于验证气体的某些化学性质,所得现象和结论均正确的是
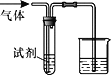
气体 | 试剂 | 现象 | 结论 | |
A | CH2=CH2 | 溴水 | 溶液褪色 | C2H4能与Br2发生取代反应 |
B | CO2 | BaCl2溶液 | 产生白色沉淀 | CO2能与可溶性钡盐反应 |
C | Cl2 | FeCl2溶液 | 溶液变为棕黄色 | 氧化性Cl2>Fe3+ |
D | SO2 | KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器或用品:①铁架台(含铁圈、各式铁夹)②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯 ⑤玻璃棒(普通) ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩漏斗;
现有下列药品:a.NaOH固体 b.标准NaOH溶液 c.未知浓度盐酸 d.蒸馏水e.碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是______________。
(2)做中和反应反应热的测定实验时,还缺乏的玻璃仪器有____________、___________。
(3)准确量取25.00ml碳酸钠溶液,可选用的仪器是__________。
A.25ml量筒 B.25ml酸式滴定管
C.25ml碱式滴定管 D.有刻度的50ml烧杯
(4)进行中和滴定时,不可预先用待装液润洗的仪器是下列的__________(填编号)。
A、酸式滴定管 B、碱式滴定管 C、锥形瓶
(5)用标准强碱溶液滴定盐酸时,滴定前,滴定管尖端有气泡,滴定后气泡消失,会使得测定的盐酸浓度结果_____________。(填“偏高”、“偏低”或“不影响”,下同)
(6)用标准强碱溶液去滴定未知浓度盐酸,用滴定管取10.00ml盐酸溶液入锥形瓶时,前仰视、后俯视读数,会使得测定的盐酸浓度结果___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器发生下列反应:aA(g)![]() cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. 平衡向正反应方向移动
B. a<c+d
C. D的体积分数增大
D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1 ,
(2)2Ag(s)+1/2O2(g)=Ag2O(s) △H=-31.0kJ·mol-1,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
A. -317.3kJ·mol-1 B. -379.3kJ·mol-1 C. -332.8kJ·mol-1 D. +317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该反应历程示意如下:

下列说法不正确的是
A.该反应遵循质量守恒定律
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②吸收能量并形成了C—C键
D.生成CH3COOH总反应的原子利用率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究化学反应2Fe2++I2 ![]() 2Fe3++2I-,完成了如下实验:
2Fe3++2I-,完成了如下实验:
已知:Agl是黄色固体,不溶于稀硝酸。新制的AgI见光会少量分解。

(1)Ⅰ、Ⅱ均未检出Fe3+,检验Ⅱ中有无Fe3+的实验操作及现象是:取少量Ⅱ中溶液,___________。
(2)Ⅲ中的黄色浑浊是___________。
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。进一步探究表明产生Fe3+的主要原因是Fe2+被I2氧化。Fe3+产生的其它途径还可能是___________(用离子方程式表示)。
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
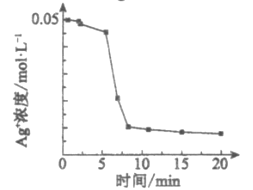
(实验1)向1 mL0.1mol/L FeSO4溶液中加入1 mL0.1mol/LAgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如下图。
(实验2)实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
①实验1中发生反应的离子方程式是___________。
②通过以上实验,小组同学怀疑上述反应的产物之一可作反应本身的催化剂。则Ⅳ中几秒钟后即出现灰黑色浑浊的可能原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计不能达到目的的是

A. 实验I:所示装置可制备氨气 B. 实验Ⅱ:检验电解饱和食盐水的产物Cl2
C. 实验Ⅲ:制取并观察Fe(OH)2沉淀 D. 实验IV:吸收SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com