
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
【答案】B
【解析】根据图像,A点时,0.05 mol/L的二元酸H2A的溶液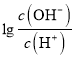 = -12,此时c(OH-)=10-12c(H+),c(OH-)=1.0×10-13 mol/L,c(H+)=0.1 mol/L,说明H2A为二元强酸。A、H2A的电离方程式为H2A=2H++A 2-,故A错误;B、B点溶液中,加入了10mL 0.10 mol/L的氨水,恰好完全反应,此时溶液应为(NH4)2A溶液,
= -12,此时c(OH-)=10-12c(H+),c(OH-)=1.0×10-13 mol/L,c(H+)=0.1 mol/L,说明H2A为二元强酸。A、H2A的电离方程式为H2A=2H++A 2-,故A错误;B、B点溶液中,加入了10mL 0.10 mol/L的氨水,恰好完全反应,此时溶液应为(NH4)2A溶液, 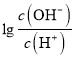 = -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,此时溶液因NH4+水解呈酸性,溶液中的氢离子均是水电离产生的,故水电离出的氢离子浓度为1.0×10-6 mol/L,故B正确;C、C点溶液中,加入了12.5 mL 0.10 mol/L的氨水,此时溶液应为(NH4)2A和NH3·H2O混合溶液,
= -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,此时溶液因NH4+水解呈酸性,溶液中的氢离子均是水电离产生的,故水电离出的氢离子浓度为1.0×10-6 mol/L,故B正确;C、C点溶液中,加入了12.5 mL 0.10 mol/L的氨水,此时溶液应为(NH4)2A和NH3·H2O混合溶液, 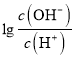 = 0,c(OH-)=c(H+),根据电荷守恒:c(NH4+)+c(H+)= 2c(A2-)+c(OH-),即c(NH4+)= 2c(A2-),故C错误;D、B点时,溶液应为0.025mol/L(NH4)2A溶液,
= 0,c(OH-)=c(H+),根据电荷守恒:c(NH4+)+c(H+)= 2c(A2-)+c(OH-),即c(NH4+)= 2c(A2-),故C错误;D、B点时,溶液应为0.025mol/L(NH4)2A溶液, 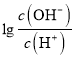 = -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,溶液因NH4+水解呈酸性,NH4++ H2O
= -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,溶液因NH4+水解呈酸性,NH4++ H2O![]() H++ NH3·H2O,该反应的水解常数为Kh=
H++ NH3·H2O,该反应的水解常数为Kh=![]() =
=![]() =
= ![]() =2×10-5,故氨水的电离平衡常数为
=2×10-5,故氨水的电离平衡常数为![]() =5×10-10,故D错误;故选B。
=5×10-10,故D错误;故选B。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子中,能大量共存的一组是…………………………………………( )
A.K+、NO3-、Na+、CO32-B.Na+、Cl-、H+、HCO3-
C.Mg2+、Al3+、Cl-、OH-D.Ca+、CO32-、K+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为“21世纪的金属”,在工农业生产、医疗、国防、科技等方面中有着极其广泛而重要的用途。四氯化钛是工业上制备金属钛的重要原料。在常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4的反应原理为:TiO2+2C+2Cl2![]() =TiCl4+2CO。
=TiCl4+2CO。
下图是实验室模拟工业生产制备四氯化钛的反应装置,其主要操作步骤有(顺序己打乱):
①连接好整套装置,并检査装置的气密性;
②当锥形瓶中的TiCl4的量不再增加时,停止加热,改通CO2气体直至电炉中的瓷管冷却为止;
③将Ti02、炭粉混合均匀后,装入管式电炉中;
④将电炉升温至800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水;
⑤通入干燥的CO2气体并持续一段时间。

试回答:
(1)仪器F的名称是_______________,装罝A所用的试剂名称是_______________。
(2)正确的操作程序是(填写操作步骤的序号)______________________________。
(3)操作⑤的目的是______________________________。
(4)装置中冷凝管进水口的位置是(填a或b)_______________,装置E的作用_______________。
(5)将少量TiCl4露置于空气中,可能看到的现象是______________________________。
(6)利用化合物TiCl4可制备TiO2,请结合化学用语解释该过程:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不正确的是( )

A.氧化性强弱:Br2 > Fe3+
B.由图可知,该FeBr2溶液的浓度为1 mol·L-l
C.n(Cl2)=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1时,反应的离子方程式为:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiCl4是一种遇水强烈水解,并放出大量的热的化合物。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)来制备BaCl2·2H2O,工艺流程如下:
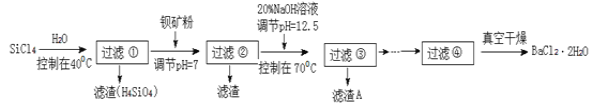
已知:①常温下Fe3+ 、Mg2+ 完全沉淀的 pH 分别是3.4、12.4。
②Ge与Si同主族位于Si的下一周期。
(1)Ge的原子序数________
(2)请用电子式表示C2H2的形成过程_____________________________。
(3)SiCl4发生水解反应的化学方程式____________________________。
(4)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,请写出该反应的化学方程式_____________________________________。
(5)加钡矿粉调节pH=7的作用是:①使BaCO3转化为BaCl2;②________________________
(6)生成滤渣A的离子方程式:______________________________;
(7)BaCl2滤液经__________、__________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(8)10 吨含78.8% BaCO3的钡矿粉理论上最多能生成 BaCl2·2H2O___________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用于验证气体的某些化学性质,所得现象和结论均正确的是
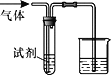
气体 | 试剂 | 现象 | 结论 | |
A | CH2=CH2 | 溴水 | 溶液褪色 | C2H4能与Br2发生取代反应 |
B | CO2 | BaCl2溶液 | 产生白色沉淀 | CO2能与可溶性钡盐反应 |
C | Cl2 | FeCl2溶液 | 溶液变为棕黄色 | 氧化性Cl2>Fe3+ |
D | SO2 | KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com