
【题目】某小组探究化学反应2Fe2++I2 ![]() 2Fe3++2I-,完成了如下实验:
2Fe3++2I-,完成了如下实验:
已知:Agl是黄色固体,不溶于稀硝酸。新制的AgI见光会少量分解。

(1)Ⅰ、Ⅱ均未检出Fe3+,检验Ⅱ中有无Fe3+的实验操作及现象是:取少量Ⅱ中溶液,___________。
(2)Ⅲ中的黄色浑浊是___________。
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。进一步探究表明产生Fe3+的主要原因是Fe2+被I2氧化。Fe3+产生的其它途径还可能是___________(用离子方程式表示)。
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
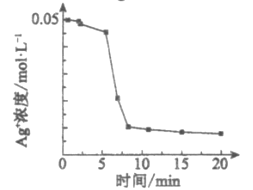
(实验1)向1 mL0.1mol/L FeSO4溶液中加入1 mL0.1mol/LAgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如下图。
(实验2)实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
①实验1中发生反应的离子方程式是___________。
②通过以上实验,小组同学怀疑上述反应的产物之一可作反应本身的催化剂。则Ⅳ中几秒钟后即出现灰黑色浑浊的可能原因是___________。
【答案】加KSCN溶液,溶液不变红 AgI 任写一个:4Fe2++O2+4H+=4Fe3++2H2O或3Fe2++4H++NO3-=3Fe3++NO↑+2H2O 合理答案均给分 Fe2++Ag+=Fe3++Ag AgI分解产生的Ag催化了Fe2+与Ag+的反应
【解析】
由实验所给现象可知,Ⅰ、Ⅱ均未检出Fe3+,说明Fe2+与I2几乎不反应;Ⅱ→Ⅲ的过程中加入几滴硝酸酸化的硝酸银溶液,Ag+与I﹣生成了AgI沉淀,降低了I﹣的浓度,使平衡2Fe2++I2 ![]() 2Fe3++2I﹣正向移动,使I2氧化了Fe2+;加入足量的硝酸酸化的硝酸银溶液,反应生成的AgI分解产生的Ag催化了Fe2+与Ag+的反应生成三价铁离子和单质银,出现大量灰黑色浑浊。
2Fe3++2I﹣正向移动,使I2氧化了Fe2+;加入足量的硝酸酸化的硝酸银溶液,反应生成的AgI分解产生的Ag催化了Fe2+与Ag+的反应生成三价铁离子和单质银,出现大量灰黑色浑浊。
(1)检验Ⅱ中有无Fe3+的实验操作及现象是:取少量Ⅱ中溶液,滴加几滴KSCN溶液,溶液不变红,故答案为:滴加几滴KSCN溶液,溶液不变红;
(2)Ⅲ中的黄色浑浊是Ag+与I﹣生成了AgI黄色沉淀,故答案为:AgI;
(3)空气中存在O2,酸性条件下,空气中氧气将Fe2+氧化为Fe3+,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;或溶液中Ag+具有氧化性,可将Fe2+氧化为Fe3+;或酸性溶液中NO3﹣具有强氧化性,可将Fe2+氧化为Fe3+,故答案为:4Fe2++O2+4H+=4Fe3++2H2O或3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(4)①向1 mL 0.1 molL﹣1 FeSO4溶液中加入1 mL0.1 molL﹣1 AgNO3溶液,开始时,溶液无明显变化,几分钟后,出现大量灰黑色浑浊,说明银离子氧化亚铁离子生成铁离子,反应的离子方程式为Fe2++Ag+=Fe3++Ag,故答案为:Fe2++Ag+=Fe3++Ag;
②依据小组同学怀疑分析可知,迅速出现灰黑色浑浊的可能的原因是AgI分解产生的Ag催化了Fe2+与Ag+的反应,故答案为:AgI分解产生的Ag催化了Fe2+与Ag+的反应。


科目:高中化学 来源: 题型:
【题目】向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不正确的是( )

A.氧化性强弱:Br2 > Fe3+
B.由图可知,该FeBr2溶液的浓度为1 mol·L-l
C.n(Cl2)=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1时,反应的离子方程式为:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用于验证气体的某些化学性质,所得现象和结论均正确的是
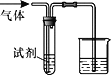
气体 | 试剂 | 现象 | 结论 | |
A | CH2=CH2 | 溴水 | 溶液褪色 | C2H4能与Br2发生取代反应 |
B | CO2 | BaCl2溶液 | 产生白色沉淀 | CO2能与可溶性钡盐反应 |
C | Cl2 | FeCl2溶液 | 溶液变为棕黄色 | 氧化性Cl2>Fe3+ |
D | SO2 | KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的过程如下:
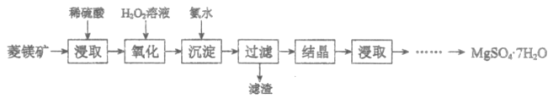
(1)MgCO3溶于稀硫酸的离子方程式是___________。
(2)“氧化”步骤中,加入H2O2溶液的目的是___________(用离子方程式表示)。
(3)“沉淀”步骤中,用氨水调节溶液pH的范围是___________。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
(4)“过滤”所得滤液中含有的阳离子是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:

(1)碳原子价层电子的轨道表达式为__________,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是_________。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是____________。
(4)EMIM+离子中,碳原子的杂化轨道类型为______。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则EMIM+离子中的大π键应表示为________。
),则EMIM+离子中的大π键应表示为________。

(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______晶体,其中硼原子的配位数为_______。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为________(列出化简后的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑧七种元素在周期表中的位置。
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑧ | |||||
3 | ① | ③ | ④ | ⑦ | ||||
4 | ② |
请回答:
(1)画出③的原子结构示意图_______________
(2)在①、②、③三种元素的最高价氧化物对应水化物中,碱性最强的是_______
(填碱的化学式)。
(3)⑦、⑧两元素对应形成的氢化物中,最稳定的是_____________(填氢化物化学式)。
(4)写出⑤和⑥形成的三原子化合物的化学式____________________
(5)写出①、④元素的最高价氧化物对应水化物之间反应生成的盐的化学式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A.化学键的断裂和生成是化学反应中能量变化的根本原因
B.凡吸热反应均需在加热条件下才能发生
C.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
D.因为石墨变成金刚石吸热,所以石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的叙述中不正确的是( )
A.合金具有熔点高硬度大等特性B.目前用量最大、用途最广泛的合金是钢
C.在我国使用最早的合金是青铜D.合金钢可制成不锈钢和特种钢等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com