
【题目】分如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
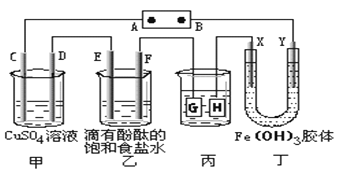
(1)B极是电源的__________,一段时间后,甲中溶液颜色_________,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明_______________,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为_______。
(3)现用丙装置给铜件镀银,则H应该是_______(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的C(OH-)=0.1mol/L时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为________,甲中溶液的pH_________(填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是_____________。
【答案】负极 逐渐变浅 氢氧化铁胶体粒子带正电 1∶2∶2∶2 镀件 AgNO3 5.4g 变小 Fe+Cu2+![]() Cu+Fe2+
Cu+Fe2+
【解析】
(1)将直流电源接通后,F极附近呈红色,可知氢离子在该电极放电,所以F即是阴极,并得到其他各个电极的名称,阳极上阴离子放电;
(2)C、D、E、F电极转移的电子数目相等,根据转移电子数可计算生成的单质的量;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,各个电极上转移的电子数是相等的;
(4)C电极换为铁,则阳极铁失电子,阴极铜离子得电子。
(1)B电极是电源的负极,在A池中,电解硫酸铜的过程中,铜离子逐渐减少,导致溶液颜色变浅;Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷;
(2)C、D、E、F电极发生的电极反应分别为:4OH-═O2↑+2H2O+4e-、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-、2H++2e-═H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,电镀液含有镀层金属阳离子,故电镀液为AgNO3溶液;当乙中溶液的c(OH-)=0.1molL-1时(此时乙溶液体积为500mL),根据电极反应2H2O+2e-═H2↑+2OH-,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,电解硫酸铜的过程中水放电生成氧气,有硫酸生成,所以氢离子浓度增大,所以酸性增强,甲中溶液的pH变小;
(4)C电极换为铁,则阳极铁失电子,阴极铜离子得电子,电解池反应为:Fe+Cu2+![]() Cu+Fe2+。
Cu+Fe2+。


科目:高中化学 来源: 题型:
【题目】铁在热的稀![]() 中反应,其主要还原产物为
中反应,其主要还原产物为![]() ,而在冷的稀
,而在冷的稀![]() 中反应,其主要还原产物为NO,当溶液更稀时,其还原产物为
中反应,其主要还原产物为NO,当溶液更稀时,其还原产物为![]() 。请分析如图,回答有关问题。
。请分析如图,回答有关问题。
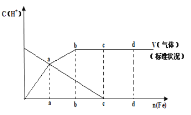
![]() 假设在任一气体产生的曲线段内只有一种还原产物,试配平由b点到c点时的化学反应方程式:_____Fe+____HNO3—____Fe(NO3)3+_________+____H2O
假设在任一气体产生的曲线段内只有一种还原产物,试配平由b点到c点时的化学反应方程式:_____Fe+____HNO3—____Fe(NO3)3+_________+____H2O
![]() 判断从o点到a点时的还原产物,应是___________
判断从o点到a点时的还原产物,应是___________
![]() 点到b点时产生还原产物为_________,其原因是______________
点到b点时产生还原产物为_________,其原因是______________
![]() 已知达到d点时反应完全结束,此时溶液中的主要阳离子为____________。
已知达到d点时反应完全结束,此时溶液中的主要阳离子为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏加德罗常数的数值,下列叙述正确的是
A.1molL-1 MgCl2溶液中的Mg2+数为NA
B.1 mol Na2O2固体中含阴离子总数为2NA
C.5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 NA
D.100 mL 12molL-1浓盐酸与足量MnO2加热反应,转移电子数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用0.2000mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O42H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0g草酸晶体,配成250.00mL水溶液.此操作过程必须用到的2种定量仪器是 ______ 和 ______ .
(2)量取草酸溶液25.00mL放入锥形瓶中,用0.2000mol/L的酸性KMnO4溶液滴定.
①量取25.00mL草酸溶液
②酸化KMnO4溶液的酸应为 ______ .(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:_______________________ □MnO4-+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是 ______ .
![]()
(3)在上述实验中,下列操作一定会造成测定结果偏低的是 ______ .
A.称取13.0g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是( )
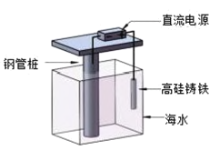
A.利用了电解原理B.电子由电源负极流向钢管桩
C.钢管桩是负极D.高硅铸铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理、回收CO是环境科学家研究的热点课题。
(1)CO用于处理大气污染物N2O所发生的反应为N2O(g)+CO(g)![]() CO2(g)+N2(g) △H。几种物质的相对能量如下:
CO2(g)+N2(g) △H。几种物质的相对能量如下:

①△H=___________ kJ·mol-1。改变下列“量”,一定会引起△H发生变化的是___________(填代号)
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:Fe++N2O===FeO++N2;第二步:____________(写化学方程式)。
第二步步反应不影响总反应达到平衡所用时间,由此推知,第二步反应速率_____第一步反应速率(填“大于”或“等于”)。
(2)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5 (s)+5CO(g)![]() 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是________。
②在此温度下,该可逆反应的平衡常数K=___________(用含x的代数式表示)。

(3)工业上,利用CO和H2合成CH3OH。在1L恒容密闭容器中充入1 mol CO(g)和 n molH2,在250℃发生反应:CO(g)+2H2(g)![]() CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___________。
CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___________。
(4)有人提出,利用2CO(g)===2C(s)+O2(g)消除CO对环境的污染,你的评价是___________(填“可行”或“不可行”)
(5)CO-空气碱性燃料电池(用KOH作电解质),当恰好完全生成KHCO3时停止放电。写出此时负极的电极反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。
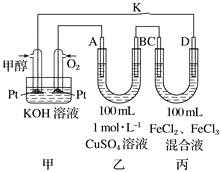
(1)写出甲池中负极电极反应式_________________________________________
(2)写出A电极的电极反应式____________________________________________
(3)写出丙中反应的离子方程式___________________________________________
(4)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。则乙中A极析出的气体在标准状况下的体积为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多含氮物质是农作物生长的营养物质。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1
③2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1
N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________________。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
①a、b、c三点逆反应速率由大到小的顺序为_______。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡_______移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________Pa-1。
(3)已知在一定温度下的可逆反应N2O4(g)![]() 2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:

则X膜为___________交换膜,正极上的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000mo l·L-1的某酸HX,滴定曲线如图所示。下列说法正确的是( )

A. HX的电离常数Ka的数量级为10-10
B. P点溶液中微粒浓度大小为:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
C. 滴定过程中可选用的指示剂有甲基橙和酚酞
D. A点到B点过程中,水电离出的c(H+)×c(OH-)先增大,后不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com