

| OH- |
| △ |
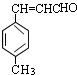 ,根据反应的条件可知,A与B发生信息中的反应生C,所以可推知A为
,根据反应的条件可知,A与B发生信息中的反应生C,所以可推知A为 ,B为CH3CHO,D与甲醇发生酯化反应生成E为CH3-
,B为CH3CHO,D与甲醇发生酯化反应生成E为CH3- =CHCOOCH3,据此答题.
=CHCOOCH3,据此答题. ,根据反应的条件可知,A与B发生信息中的反应生C,所以可推知A为
,根据反应的条件可知,A与B发生信息中的反应生C,所以可推知A为 ,B为CH3CHO,D与甲醇发生酯化反应生成E为CH3-
,B为CH3CHO,D与甲醇发生酯化反应生成E为CH3- =CHCOOCH3,
=CHCOOCH3, ,由于高锰酸钾溶液能氧化碳碳双键和苯环侧链上的取代基,所以化合物C发生氧化反应生成D,不能用酸性KMnO4溶溶代替银氨溶液,
,由于高锰酸钾溶液能氧化碳碳双键和苯环侧链上的取代基,所以化合物C发生氧化反应生成D,不能用酸性KMnO4溶溶代替银氨溶液, +CH3CHO
+CH3CHO | OH- |
| △ |
 +H2O,
+H2O, +CH3CHO
+CH3CHO | OH- |
| △ |
 +H2O;
+H2O; =CHCOOCH3,E在一定条件下通过加聚反应可以生成高聚物F,F的结构简式为
=CHCOOCH3,E在一定条件下通过加聚反应可以生成高聚物F,F的结构简式为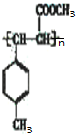 ,
,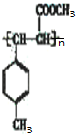 ;
;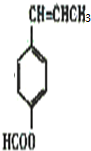 、
、 、
、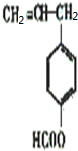 、
、 ,各有邻间对三种,所以共有12种,其中2种同分异构体的结构简式为
,各有邻间对三种,所以共有12种,其中2种同分异构体的结构简式为 、
、 、
、 、
、 (其中两种),
(其中两种), 、
、 、
、 、
、 (其中两种).
(其中两种).


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
A、硫离子的结构示意图: |
B、NH4Cl的电子式: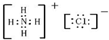 |
C、CO2的电子式: |
| D、次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)元素的第一电离能:N
(1)元素的第一电离能:N| 电离能 | I1 | I2 | I3 | I4 | … |
| In/kJ?mol-1 | 578 | 1817 | 2745 | 11575 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在中和热测定实验中,为准确测得反应前后的温差,应将已分别测得温度的氢氧化钠溶液与盐酸在隔热的容器中快速混合,并不断搅拌,用温度计测量混合液的最高温度 |
| B、往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 |
| C、将溴乙烷与氢氧化钾混合液加热,再滴加硝酸银溶液,观察有淡黄色沉淀生成,可证明溴乙烷中含有溴 |
| D、润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1s22s22p2 |
| B、1s22s22p5 |
| C、1s22s22p63s23p4 |
| D、1s22s22p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙:
乙: 丙:
丙:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li在氧气中燃烧主要生成Li2O2 |
| B、将SO2通入BaCl2溶液可生成BaSO3沉淀 |
| C、将CO2通入次氯酸钙溶液可生成次氯酸 |
| D、将CO通入热的CuSO4溶液中能使Cu2+还原成Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com