
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
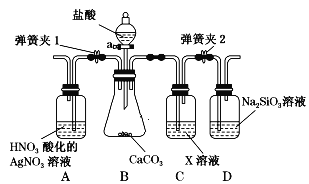
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭活塞。
请回答:
(1)仪器a的名称:___________________。
(2)通过步骤 Ⅰ、 Ⅱ 得知盐酸具有的性质是________(填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
(3)C装置的作用是______________,X是____________________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是________,D中反应的化学方程式是__________。
(5)碳、硅的非金属性逐渐减弱的原因是___________(从原子结构角度加以解释)。
【答案】分液漏斗 A、D 除HCl气体 NaHCO3 打开弹簧夹2,关闭弹簧夹1,当D中出现白色胶状沉淀后 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3 碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱
【解析】
Ⅰ.打开弹簧夹1,关闭弹簧夹2,打开活塞,滴加盐酸,B中发生盐酸与碳酸钙的反应,生成氯化钙、水、二氧化碳;Ⅱ.关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后,A中看到白色沉淀时,关闭活塞;C装置中X为碳酸氢钠溶液,与挥发的盐酸反应,可除去二氧化碳中混有的HCl;D中发生二氧化碳与硅酸钠溶液的反应。
(1)仪器a的名称是分液漏斗;
答案:分液漏斗
(2)步骤Ⅰ反应CaCO3+2HCl=CaCl2+CO2↑+H2O ,步骤Ⅱ反应AgNO3+HCl=AgCl↓+HNO3,体现了盐酸的酸性和挥发性;
答案:A、D
(3)C装置的作用是除HCl气体,X为碳酸氢钠溶液,与挥发的盐酸反应,可除去二氧化碳中混有的HCl;
答案:除HCl气体 NaHCO3
(4)步骤Ⅱ中未写的操作和现象是关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后,A中看到白色沉淀时,关闭活塞;D中发生二氧化碳与硅酸钠溶液的反应,该反应为Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
答案: 打开弹簧夹2,关闭弹簧夹1,当D中出现白色胶状沉淀后 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
(5)碳、硅的非金属性逐渐减弱的原因是碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱;
答案:碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱。


科目:高中化学 来源: 题型:
【题目】瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先制得了氯气。如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
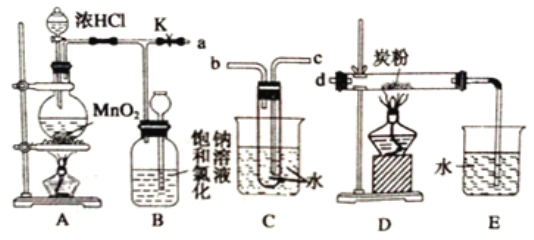
(1)A中制取Cl2反应的化学方程式是_________。
(2)要将C装置接入B和D之间,正确的接法是a→________→_____________→d。
(3)实验开始先点燃A处的酒精灯,打开夹子K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钚(Pu)作为热源材料,常用来驱动太空船。下列关于![]() 的说法正确的是 ( )
的说法正确的是 ( )
A. ![]() 与
与![]() 具有相同的化学性质B.
具有相同的化学性质B. ![]() 与
与![]() 互为同素异形体
互为同素异形体
C. ![]() 与
与![]() 互为同位素D.
互为同位素D. ![]() 与
与![]() 含有的中子数相同
含有的中子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微粒铵根14N2H4+中的中子数是_______,核外电子数是_______。
(2)写出N2的电子式____,CO2的结构式______;用电子式表示H2S的形成过程_____;
(3)已知拆开1 molH—H键、1 molI—I、1 mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘反应生成1 molHI需要____(填“放出”或“吸收”)______kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制硝基苯的主要步骤如下:
① 在250mL的圆底烧瓶中放入17.7 mL苯,配上一个双孔橡皮塞,一个孔插入一支100℃温度计,其水银球要进入液面下,另一个孔插入长颈漏斗,仪器装置如图所示。

②通过长颈漏斗上口将已配制好的混酸分多次加入烧瓶中。每加一次,必须振荡烧瓶,当反应物温度不再上升而趋下降时,才可继续加混酸。反应温度应保持在40—50℃,若超过50℃,可用冷水浴冷却烧瓶,加料完毕后,把烧瓶放在水浴上加热,约10分钟内把水浴加热到55-60℃,并保持30分钟,间歇地振荡烧瓶。
③冷却后将反应物倒入分液漏斗,静置分层,分出酸液和粗硝基苯,由于工业浓H2SO4中含有少量汞盐等杂质有催化作用,使反应产物中含有苦味酸(2,4,6-三硝基苯酚)和2,4-二硝基苯酚使粗硝基苯呈浅黄色,此外还含有间二硝基苯。已知:苦味酸与2,4-二硝基苯酚均有酸性,能与碱反应;间二硝基苯性质与硝基苯类似。请回答下列问题
(1)步骤①中长颈漏斗的作用
a _______________________,b _______________。
(2)步骤 ②中,每加入一次混酸,必须振荡烧瓶的目的_____________________。
(3)步骤②中,需严格控制温度的原因___________________________________。
(4)步骤③中,静置分层后,粗硝基苯在分液漏斗_____ 层。
(5)要将粗硝基苯中混有少量酸液、苦味酸、2,4一二硝基苯酚以及二硝基苯,除去得到纯净的硝基苯必须进行的五步操作名称为a __________ 、 b _____________、c _________ 、 d _____________、e_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化硅和二氧化碳的说法中不正确的是( )
A. 都是酸性氧化物B. 都能与水反应
C. 都与氢氧化钠溶液反应D. 高温下都与单质碳反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A. 测0.1 mol/L氨水的pH为11:NH3·H2O![]() NH+OH-
NH+OH-
B. 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-
+OH-
C. 用CuCl2溶液做导电实验,灯泡发光:CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
D. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe﹣2e-=Fe 2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某溶液中Ca2+的含量,某冋学设计了如下实验:量取100 mL该溶液于烧杯中,加入足量的(NH4)2C2O4溶液使Ca2+转化为CaC2O4沉淀(假设其他离子均不生成沉淀),过滤、洗涤后,往沉淀中加入足量稀硫酸,然后用0.1000molL-1的KMnO4标准溶液滴定。
(1)配平KMnO4氧化H2C2O4的化学方程式:____________________
(2)如图所示的仪器中,配制0.1000molL-1的KMnO4标准溶液时肯定不需要的是___(填标号),除此之外还需用到的玻璃仪器是___(填仪器名称)。

(3)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1000molL-1(填“>”、“<”或“=”,下同);若KMnO4标准溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___0.1000molL-1。
(4)若滴定过程中消耗KMnO4标准溶液20.00mL,则原溶液中Ca2+的质量浓度为___gL-1。
(5)下图为草酸钙固体在受热分解过程中所得固体产物的质量随温度变化的曲线,图中A、B、C分别代表三种固体,写出固体A到B的化学方程式:_________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是 ( )
A. 二氧化硅与强碱溶液反应:SiO2+2OH-=SiO32-+H2O
B. 氯水与SO2溶液反应:Cl2+SO2+2H2O=4H++ClO-+SO32-
C. 二氧化锰与浓盐酸反应:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
D. 将二氧化氮气体通入水中:3NO2+H2O=2H++2NO3-+NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com