
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg(V/V0)的变化如图所示。
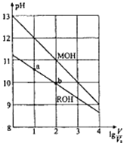
(1)MOH是___(填“强碱”或“弱碱”)。
(2)写出ROH的电离方程式___。
(3)若溶液体积相等,为了使MOH溶液与ROH溶液稀释后pH相等,加入水较多的是___。
(4)常温下,在ROH溶液中加蒸馏水稀释,下列物理量变大的是___。
A.Kw B.![]() C.c(H+) D.c(OH-)
C.c(H+) D.c(OH-)
(5)ROH的电离程度:b点___a点(填“大于”、“小于”或“等于”,下同);若无限稀释MOH、ROH溶液,最终溶液的pH:MOH溶液___ROH溶液。
【答案】强碱 ROH![]() R++OH- MOH BC 大于 等于
R++OH- MOH BC 大于 等于
【解析】
(1)、0.10mol/L的MOH pH为13,故MOH是强碱;
(2)、0.10mol/L的ROH pH不为13,故ROH是弱碱,所以电离方程式为ROH![]() R++OH-;
R++OH-;
(3)、由图可知,稀释至相同pH,即做一条垂直于Y轴的垂线,所以加水较多的为MOH;
(4)、Kw随温度变化,A不选;![]() =
=![]() ,稀释碱性变弱,c(OH-)降低,故
,稀释碱性变弱,c(OH-)降低,故![]() 增大,c(OH-)降低,所以选B,不选D;稀释碱性变弱,c(H+)增大,C选,故答案为:BC;
增大,c(OH-)降低,所以选B,不选D;稀释碱性变弱,c(H+)增大,C选,故答案为:BC;
(5)、加水稀释,促进弱碱的电离,所以b点电离程度大于a点,若无限稀释MOH、ROH溶液,最终溶液的pH为7,相等,故答案为:大于,等于;


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】用如图所示装置制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备硫酸亚铁铵晶体[(NH4)xFe(SO4)y·6H2O]。硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
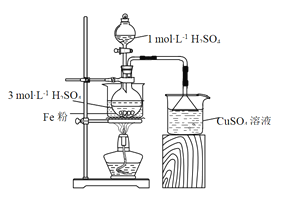
(1)实验装置:反应过程中会产生少量PH3气体,需使用封闭装置。用CuSO4溶液吸收PH3时会生成H3PO4和Cu。该反应的化学方程式为_______。
(2)药品用量:将2 g Fe粉、10 mL 3 mol·L-1 H2SO4溶液加入烧瓶中反应。采取该原料配比的主要原因是_______。
(3)制备FeSO4溶液:保持温度70~80 ℃,至反应无明显气泡产生,停止加热,过滤。
(4)制备(NH4)xFe(SO4)y·6H2O:向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80 ℃条件下溶解后,趁热倒入50 mL乙醇中,析出晶体。乙醇的作用为_______。
(5)测定化学式:将一定量(NH4)xFe(SO4)y·6H2O晶体加入到过量NaOH溶液中,并加热,生NH3 1.12 L(标准状况),过滤、洗涤、灼烧,得Fe2O3固体2.0 g。通过计算确定硫酸亚铁铵晶体的化学式。(写出计算过程)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:

已知:反应Ⅱ包含2NaHSO3![]() Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:__________________。
(2)反应I的化学方程式为________________________。
(3)“灼烧”时发生反应的化学方程式:______________。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为__________________。
(5)副产品X的化学式是____________。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:
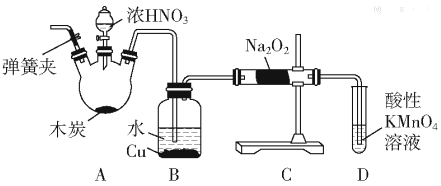
已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)检査完该装置的气密性,装入药品后,实验开始前通入一段时间气体Ar,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡。上述操作的作用是___。
(2)B中观察到的主要现象是___;
(3)A装置中反应的化学方程式为___;
(4)D装置中反应的离子方程式___;
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和___。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为___。
(6)利用改进后的装置,将3.12gNa2O2完全转化成为NaNO2,理论上至少需要木炭___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)在下列化合物:①CH4②C2H2③(CH3)2C=CHCH3④CH2=CHCH=CH2⑤环戊烷⑥C6H14⑦![]() 中,互为同系物的是___(填序号,下同),互为同分异构体的是___,发生加聚反应后的产物中具有单双键相间排列结构的单体是___。
中,互为同系物的是___(填序号,下同),互为同分异构体的是___,发生加聚反应后的产物中具有单双键相间排列结构的单体是___。
(2)分子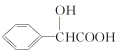 中含有的官能团名称为___。
中含有的官能团名称为___。
(3)某有机物分子式为C8H8,且属于芳香烃,已知它可使酸性高锰酸钾溶液和溴水褪色,则该有机物的结构简式为____。
(4)某烃的含氧衍生物可以作为无铅汽油的抗爆震剂,它的相对分子质量为88.0,含碳的质量分数为68.2%,含氢的质量分数为13.6%,红外光谱和核磁共振氢谱显示该分子中有4个甲基,请写出其结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机锗具有抗肿瘤活性,锗元素的部分信息如右图。则下列说法不正确的是

A. x=2
B. 锗元素与碳元素位于同一族,属于ⅣA族
C. 锗位于元素周期表第4周期,原子半径大于碳的原子半径
D. 距离锗原子核较远区城内运动的电子能量较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
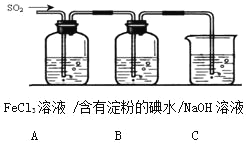
(1)下列实验方案适用于在实验室制取所需SO2的是________(填序号).
A Na2SO3溶液与HNO3 B Na2SO3固体与浓硫酸
C 固体硫在纯氧中燃烧D 铜与热浓H2SO4
(2)装置C的作用是_______
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、____自然干燥,在这一系列操作中没有用到的仪器有____(填序号).
A 蒸发皿B 石棉网C 漏斗D 烧杯E 玻璃棒F 坩埚
(4)在上述装置中通入SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第二份试液加入铁氰化钾溶液,产生蓝色沉淀。
方案②:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是___________ 。
(5)能表明I的还原性弱于SO2的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)是全球硫循环的重要中间体,也是有机合成中的重要原料,是化学工作者重要的研究对象。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △Hl=-17kJ/mol;
H2S(g)+CO(g) △Hl=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=________。
H2(g)+CO2(g)的△H=________。
(2)在充有催化剂的恒压密闭容器中进行反应I。设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示。
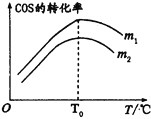 ①m1________m2(填>、<或=)。
①m1________m2(填>、<或=)。
②温度高于T0时,COS转化率减小的可能原因为_________。
A.有副反应发生。
B.反应的△H增大。
C.催化剂活性降低。
D.逆反应速率增大的倍数小于正反应速率增大的倍数
(3)在恒温、恒容密闭容器中.进行反应I。下列说法中能说明反应I已达到平衡状态的是___________。
A.c(H2S)=c(CO) B.v正(H2)=v逆(H2S)
C.容器中气体密度保持不变 D.容器中混合气体平均摩尔质量保持不变
E.c(COS)保持不变
(4)某温度下,向体积为2 L的恒容密闭容器中通入5 mol COS(g)和5 molH2O(g),发生反应Ⅱ,5 min后反应达到平衡,测得COS(g)的转化率为80%。
①反应从起始至5 min内,用H2S浓度变化表示的平均反应速度v(H2S)=________。
②该温度下,上述反应的平衡常数K=________。
③其他条件相同时,既能使上述反应中COS的平衡转化率降低,又能使反应速率加快的做法是________。
A.缩小容器容积 B.升高温度
C.分离出硫化氢 D.加入一定量H2O(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com