
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
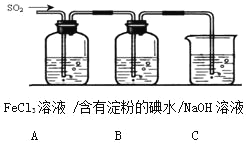
(1)下列实验方案适用于在实验室制取所需SO2的是________(填序号).
A Na2SO3溶液与HNO3 B Na2SO3固体与浓硫酸
C 固体硫在纯氧中燃烧D 铜与热浓H2SO4
(2)装置C的作用是_______
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、____自然干燥,在这一系列操作中没有用到的仪器有____(填序号).
A 蒸发皿B 石棉网C 漏斗D 烧杯E 玻璃棒F 坩埚
(4)在上述装置中通入SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第二份试液加入铁氰化钾溶液,产生蓝色沉淀。
方案②:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是___________ 。
(5)能表明I的还原性弱于SO2的化学方程式为________。
【答案】BD 吸收SO2尾气,防止污染空气 洗涤 BF 方案② A的溶液中含有SO2,能使KMnO4溶液褪色 SO2+I2+2H2O=2HI+H2SO4
【解析】
为验证二氧化硫具有还原性,可将二氧化硫通入到具有氧化性的溶液中并产生明显的现象,将二氧化硫通入氯化铁溶液中,若A中的溶液由黄色变为浅绿色,则说明二氧化硫具有还原性,氯化铁中三价铁离子具有氧化性,发生氧化还原反应,生成硫酸亚铁和盐酸,亚铁离子遇到铁氰化钾溶液,产生蓝色沉淀,可以用来检验亚铁离子;再继续通入到含有淀粉的碘水溶液中,若溶液由蓝色变浅消失,说明碘水中的碘单质减少,被还原为碘离子,进而证明二氧化硫具有还原性,由于二氧化硫是酸性氧化物,有毒气体,属于大气污染物,不能直接排放到大气中,一般用碱液进行吸收处理。
(1)A.硝酸具有强氧化性,能够将亚硫酸钠氧化成硫酸钠,无法得到二氧化硫气体,故A错误;
B. 浓硫酸虽具有强酸性,且浓硫酸不挥发,亚硫酸钠溶液与浓硫酸能够反应生成二氧化硫气体,故B正确;
C. 固体硫在纯氧中燃烧,氧气用量不容易控制,且无法获得纯净的二氧化硫,故C错误;
D. 铜与浓硫酸在加热条件下生成二氧化硫、硫酸铜和水,可知制备二氧化硫,故D正确;
故答案为:BD;
(2)二氧化硫气体是酸性氧化物,具有刺激性气味,直接排放会污染大气,由于二氧化硫能和碱反应生成盐和水,可用碱液处理二氧化硫,反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O,所以装置C的作用为:吸收SO2尾气,防止污染空气,
故答案为:吸收SO2尾气,防止污染空气;
(3)溶液中得到绿矾的实验操作是蒸发浓缩,冷却结晶,过滤洗涤,干燥步骤得到,蒸发结晶过程在蒸发皿中进行,蒸发皿可直接加热,不需要石棉网;过滤洗涤操作用到的仪器为漏斗、烧杯、玻璃棒,所以在这一系列操作中没有用到的仪器有石棉网、坩埚,
故答案为:洗涤;BF;
(4)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以方案②不合理,因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色,方案①亚铁离子遇到铁氰化钾溶液,产生蓝色沉淀,可以用来检验亚铁离子,方案③SO2与Fe3+发生了氧化还原反应,SO2被Fe3+氧化为SO42-,只需检验出SO42-,加入用稀盐酸酸化的BaCl2,产生白色沉淀,可证明发生了氧化还原反应。
故答案为:方案②;A的溶液中含有SO2,能使KMnO4溶液褪色;
(5)还原剂的还原性大于还原产物,所以能表明I的还原性弱于SO2的化学方程式为SO2+I2+2H2O=2HI+H2SO4,
故答案为:SO2+I2+2H2O=2HI+H2SO4。


科目:高中化学 来源: 题型:
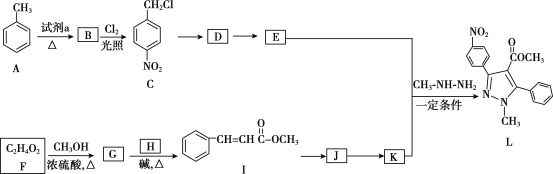
【题目】吡唑类化合物是重要的医用中间体,如图是吡唑类物质L的合成路线。
已知:R1—CHO+R2CH2—COOR3![]()
R1—CHO+R2NH2![]() R1—CH=N—R2
R1—CH=N—R2
(1)试剂a是__。
(2)C生成D的反应类型是__。
(3)D生成E的化学方程式是___。
(4)生成G的化学方程式是__。
(5)H的结构简式是__。
(6)写出符合下列条件的I的同分异构体的结构简式__。
a.是反式结构
b.能发生银镜反应
c.苯环上的一氯代物有2种
d.1mol该有机物能与2mol氢氧化钠反应
(7)K的分子式是C10H8O2,K的结构简式是__。
(8)以2-甲基丙烯和乙酸为原料,选用必要的无机试剂,合成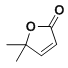 ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg(V/V0)的变化如图所示。
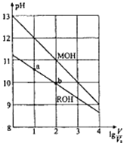
(1)MOH是___(填“强碱”或“弱碱”)。
(2)写出ROH的电离方程式___。
(3)若溶液体积相等,为了使MOH溶液与ROH溶液稀释后pH相等,加入水较多的是___。
(4)常温下,在ROH溶液中加蒸馏水稀释,下列物理量变大的是___。
A.Kw B.![]() C.c(H+) D.c(OH-)
C.c(H+) D.c(OH-)
(5)ROH的电离程度:b点___a点(填“大于”、“小于”或“等于”,下同);若无限稀释MOH、ROH溶液,最终溶液的pH:MOH溶液___ROH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2—二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用如图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,用于制备乙烯,试管d中装有液溴(表面覆盖少量水)。下列有关说法不正确的是( )
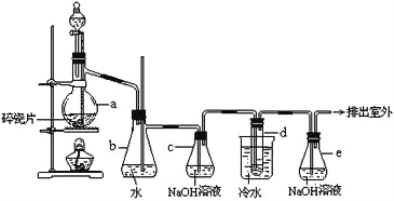
A.实验中为了防止有机物大量挥发,应迅速升高反应温度至170℃
B.装置c和装置e中都盛有NaOH溶液,其吸收的杂质不相同
C.制备乙烯和生成1,2—二溴乙烷的反应类型分别是消去反应和加成反应
D.向d中产物加入饱和Na2CO3溶液震荡静置,可用分液的方法进行分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以旋转,结构简式为 ![]() 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中最多有6个碳原子处于同一直线上
B. 该烃苯环上的一氯代物有3种
C. 分子中至少有12个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸加热反应制取乙烯,请回答下列问题:
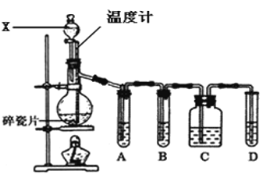
(1)写出实验室制乙烯的化学反应方程式:___,该反应中浓硫酸的作用是:___,___。
(2)有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试回答下列问题:
①图中A、B、C、D4个装置可盛放的试剂是A___,B___,C___,D__(将下列有关试剂的名称填入空格内)。
(1)品红溶液 (2)NaOH溶液 (3)KMnO4溶液
②能说明二氧化硫气体存在的现象是___。
③使用装置B的目的是___。
④使用装置C的目的是___。
⑤能证明含有乙烯的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
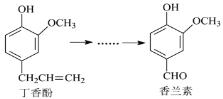
有关上述两种化合物的说法正确的是( )
A.丁香酚不能与FeCl3溶液发生显色反应
B.常温下,1mol丁香酚只能与1molBr2反应
C.香兰素分子中至少有12个原子共平面
D.1mol香兰素最多能与3mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
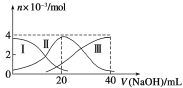
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-) >c(H+) >c(OH-)
B.等浓度的NaOH溶液与H2A溶液按2∶1混合后,其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com