
����Ŀ���������������Ҫ��ҽ���м��壬��ͼ������������L�ĺϳ�·�ߡ�
��֪��R1��CHO+R2CH2��COOR3![]()
R1��CHO+R2NH2![]() R1��CH=N��R2
R1��CH=N��R2
��1���Լ�a��__��
��2��C����D�ķ�Ӧ������__��
��3��D����E�Ļ�ѧ����ʽ��___��
��4������G�Ļ�ѧ����ʽ��__��
��5��H�Ľṹ��ʽ��__��
��6��д����������������I��ͬ���칹��Ľṹ��ʽ__��
a.�Ƿ�ʽ�ṹ
b.�ܷ���������Ӧ
c.�����ϵ�һ�ȴ�����2��
d.1mol���л�������2mol�������Ʒ�Ӧ
��7��K�ķ���ʽ��C10H8O2��K�Ľṹ��ʽ��__��
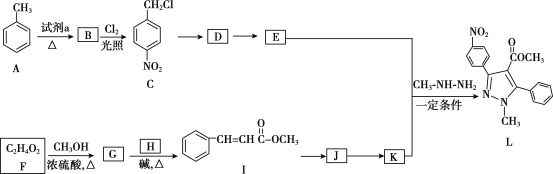
��8����2-����ϩ������Ϊԭ�ϣ�ѡ�ñ�Ҫ�����Լ����ϳ�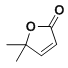 ��д���ϳ�·��__���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������
��д���ϳ�·��__���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������
���𰸡�Ũ���ᣬŨ���� ȡ����ˮ�⣩��Ӧ 2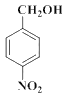 +O2
+O2![]() 2
2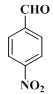 +2H2O CH3COOH+CH3OH
+2H2O CH3COOH+CH3OH![]() CH3COOCH3+H2O
CH3COOCH3+H2O 



��������
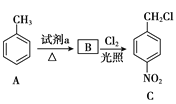 ��B�ڹ�������������������ȡ����Ӧ����
��B�ڹ�������������������ȡ����Ӧ����![]() �����ƿ�֪B��
�����ƿ�֪B��![]() ��A����������Ӧ����B��F�ķ���ʽ��C2H4O��F��״���Ũ���������·�Ӧ����G����F�����ᡢG�����������
��A����������Ӧ����B��F�ķ���ʽ��C2H4O��F��״���Ũ���������·�Ӧ����G����F�����ᡢG�����������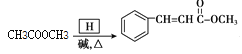 �����R1��CHO+R2CH2��COOR3
�����R1��CHO+R2CH2��COOR3![]() ����֪HΪ
����֪HΪ![]() �����R1��CHO+R2NH2
�����R1��CHO+R2NH2![]() R1��CH=N��R2��
R1��CH=N��R2��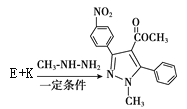 �� ���ƿ�֪E��
�� ���ƿ�֪E��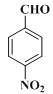 ��K�ķ���ʽ��C10H8O2��K��
��K�ķ���ʽ��C10H8O2��K��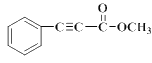 ����
���� ���ƣ�D��
���ƣ�D��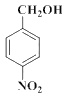 ��
��
�������Ϸ�������1��A�Ǽױ���B��![]() ��A����������Ӧ����B�������Լ�a��Ũ���ᣬŨ���
��A����������Ӧ����B�������Լ�a��Ũ���ᣬŨ���
��2��C��![]() ��D��
��D�� ��C����D��±������ˮ�ⷴӦ����Ӧ������ȡ����ˮ�⣩��Ӧ��
��C����D��±������ˮ�ⷴӦ����Ӧ������ȡ����ˮ�⣩��Ӧ��
��3��D�� ��E��
��E�� ��D����E�Ǵ��Ĵ���������Ӧ�Ļ�ѧ����ʽ��2
��D����E�Ǵ��Ĵ���������Ӧ�Ļ�ѧ����ʽ��2 +O2
+O2![]() 2
2 +2H2O��
+2H2O��
��4��G���������������ͼ״�����Ũ���������·�Ӧ���������������Ӧ�Ļ�ѧ����ʽ��CH3COOH+CH3OH![]() CH3COOCH3+H2O��
CH3COOCH3+H2O��
��5�� �����R1��CHO+R2CH2��COOR3
�����R1��CHO+R2CH2��COOR3![]() ����֪HΪ
����֪HΪ![]() ��
��
��6��a.�Ƿ�ʽ�ṹ��˵������̼̼˫����b.�ܷ���������Ӧ��˵������ȩ����������� c.�����ϵ�һ�ȴ�����2�֣�˵��2��ȡ�����ڱ����Ķ�λ�� d.1mol���л�������2mol�������Ʒ�Ӧ��˵���Ǽ������������������I��ͬ���칹��Ľṹ��ʽ��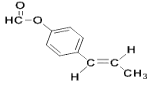 ��
��
��7�����R1��CHO+R2NH2![]() R1��CH=N��R2��
R1��CH=N��R2�� �� ���ƿ�֪E��
�� ���ƿ�֪E�� ������K�ķ���ʽ��C10H8O2����֪K��
������K�ķ���ʽ��C10H8O2����֪K��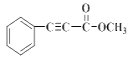 ��
��
��8��2-����ϩ����ˮ�����ӳɷ�Ӧ���� ��
�� ˮ��Ϊ
ˮ��Ϊ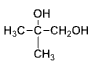 ��
�� ��ͭ������������������Ϊ
��ͭ������������������Ϊ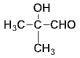 ��
��  �����ᷢ������Ӧ��Ӧ����
�����ᷢ������Ӧ��Ӧ����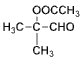 ������R1��CHO+R2CH2��COOR3
������R1��CHO+R2CH2��COOR3![]() ��
�� �ڼ���ȵ�����������
�ڼ���ȵ�����������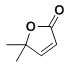 ���ϳ�·��Ϊ
���ϳ�·��Ϊ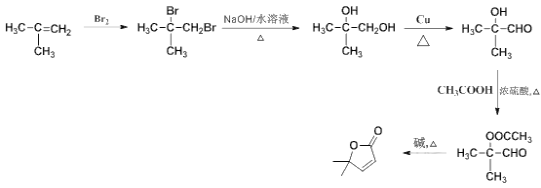 ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��֪ˮ��25���100��ʱ�������ƽ��������ͼ��ʾ��

����25��ʱˮ�ĵ���ƽ������ӦΪ_____��(����A������B��)
��25���£�����������Һ�У���ˮ������������ӵ����ʵ���Ũ��֮��a:b:c=_____��
a��pH=1������b��pH=2������c��pH=12��NaOH��Һ
��25���£���VaLpH��a��������VbLpH��b��NaOH��Һǡ���кͣ�a+b=13����Va:Vb��_____��
(2)ij�¶�(t��)ʱ�����0.01mol��L��1��NaOH��Һ��pH��13��
�ٸ��¶���ˮ��Kw��_____��
�ڴ��¶��£���pH��1��������ҺVaL��pH��14��NaOH��ҺVbL���(��������仯)����Ϻ���Һ��pHΪ2����Va:Vb��_____��
(3)����˵������ȷ����_____��
a��25��ʱ��pH=12�İ�ˮ��pH=2��H2SO4��Һ�������ϣ�������ҺpH>7
b��100��ʱ��pH=12��NaOH��Һ��pH=2��H2SO4��Һǡ���кͣ�������ҺpH=7
c��25��ʱ����ˮ�������������Ũ��Ϊ1��10��10mol/L����Һ�п��ܴ�������NH4+��Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ���������й㷺��;,����(Ni)�������缫���ŨNaOH��Һ�Ʊ���������Na2FeO4��װ����ͼ��ʾ������˵���������ǣ� ��
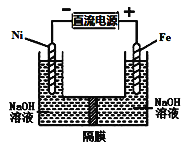
A�����缫�ϵĵ缫��ӦΪ2H2O+2e-![]() H2��+2OH-
H2��+2OH-
B����������, �缫��ӦΪFe-2e-+OH-![]() Fe(OH)2
Fe(OH)2
C������ĤΪ�����ӽ���Ĥ, ��OH-���������ƶ�
D�����ʱ������pH���͡�������pH����, ������ҺpH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С��Ϊ��̽�����������������������ʵ�鷽����
��֪�����������백����Ӧ2Al+2NH3![]() 2AlN+3H2��
2AlN+3H2��
�ڵ����������ȶ�����������ˮ���ᷴӦ���ڼ���ʱ����Ũ��ɲ���������
(1)��ͼ��ʵ�����Ʊ������ij��÷���װ�ã���ѡ��װ��b����÷���װ���еĻ�ѧ��Ӧ����ʽΪ��___________________________��
(2)����װ��c�Ľ�������ͼ��ʾ���Ӻ�װ�ã����װ�������ԣ���������ƿ�м�����ʯ�ң���Һ©���м���Ũ��ˮ��װ��G��ʢװ��ʯ�ң�װ��H�м������ۡ���װ��F����Һ©����������װ���п����ž����ٵ�ȼװ�DH���ƾ��ơ�
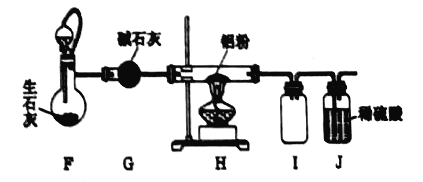
��װ��F��װ��c��ȵ��ŵ㣺 ____________________________��
����ƽ���ƶ�ԭ������װ��F�в���������ԭ�� __________________________��
��Ϊ�˵õ������ĵ��������ɽ�װ��H�й�����ȴ��ת�����ձ��У�����_______�ܽ⡢__________(���������)��ϴ�ӡ����T�ɡ�
�ܵ�����������������Һ���ȷ�Ӧ�����ӷ���ʽ�� __________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����

��ش�
����ͼ 1 ��ʾװ�ý��е�һ��ʵ�顣
��1���ڱ�֤�缫��Ӧ���������£�������� Cu ���缫����__������ĸ��ţ���
A �� B ʯī C �� D ��
��2��N ��������Ӧ�ĵ缫��ӦʽΪ__��
����ͼ 2 ��ʾװ�ý��еڶ���ʵ�顣ʵ������У��۲쵽���һ��ʵ�鲻ͬ�����������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ���塣 �������ϵ�֪������������ӣ�FeO42-������Һ�г��Ϻ�ɫ��
��3���������У�X ������Һ�� pH__����������������С����������������
��4���������У�Y �������ĵ缫��Ӧ֮һΪ Fe��6e��+8OH��= FeO42-+4H2O ���� X ���ռ���672 mL ���壬�� Y ���ռ��� 168 mL ���壨��������Ϊ��״��ʱ������������� Y �缫�����缫����������____g��
��5���ڼ���п����У��ø��������Ϊ�������ϣ���ط�ӦΪ 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2���õ�����������ķ�Ӧ�ĵ缫��ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ᣬ�䱾����NO![]() �������ԣ�ij����ʵ��С������������й�NO
�������ԣ�ij����ʵ��С������������й�NO![]() �����Ե�̽����ʵ�����ͨ�������ɣ���
�����Ե�̽����ʵ�����ͨ�������ɣ���
ʵ��װ�� | ��� | ��ҺX | ʵ������ |
| ʵ���� | 6mol��L-1ϡ���� | ������ָ������ƫת��ͭƬ���������ɫ���壬��Һ���Ϸ���Ϊ����ɫ�� |
ʵ���� | 15mol��L-1Ũ���� | ������ָ��������ƫת���ܿ���ƫ����ߣ���Ƭ��ͭƬ�����������ɫ���壬��Һ��Ϊ��ɫ�� |
��д��ͭ��ϡ���ᷴӦ�����ӷ���ʽ_____��
��ʵ�����У���Ƭ��_____������������������������Һ���Ϸ���������ɫ����Ļ�ѧ����ʽ��_____��
��ʵ�����е�����ָ����ƫ���ұߺ�ƫ����ߵ�ԭ����______��
�������ϣ����ý�����1mol��L-1ϡ���ᷴӦ��H2��NH![]() ���ɣ�NH
���ɣ�NH![]() ���ɵ�ԭ���Dz���H2�Ĺ�����NO
���ɵ�ԭ���Dz���H2�Ĺ�����NO![]() ����ԭ��
����ԭ��
������ͼװ�ý���ʵ��������ҺXΪ1mol��L-1ϡ������Һ���۲쵽������ָ������ƫת����Ӧ�����Һ�к�NH![]() ������NH
������NH![]() �ĵ缫�����ķ�Ӧ��_____������������Ӧ��������ԭ��Ӧ������
�ĵ缫�����ķ�Ӧ��_____������������Ӧ��������ԭ��Ӧ������
�ɽ�һ��̽������������NO![]() �������ԣ�����ʵ��������ͼ����
�������ԣ�����ʵ��������ͼ����
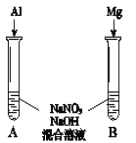
���۲쵽A����NH3���ɣ�B������������A��B������ͬ�����ԭ����_____��
��A������NH3�����ӷ���ʽ��______��
�ʽ����ۼ��뵽NaNO3��Һ�������������ʵ��������˵������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ��������ķ�Ӧװ����ͼ��ʾ������֮һ�ǽ�����a��Ũ�����Ũ�����γɵĻ�����뵽װ�б���������ƿ�У���������������ȷ���ǣ� ��
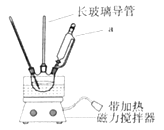
A.����a�������Ǻ�ѹ��Һ©��
B.���������ܿ�������������������
C.���ƻ���ʱӦ���ձ����ȼ���Ũ����
D.���������������Ҫ�����Ƿ�Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10 mL 0.1 mol/L��CuCl2��Һ�еμ�0.1 mol/L��Na2S��Һ���μӹ�������Һ��-lgc(Cu2+)������Na2S��Һ����ı仯��ͼ��ʾ(���Եμӹ����е��¶ȱ仯����Һ����仯)������������ȷ����( )
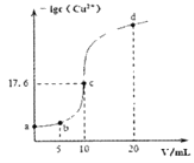
A. ������Ksp (CuS)��������Ϊ10-30
B. c����Һ��ˮ�ĵ���̶ȴ���a���d����Һ
C. b����Һ��c(Na+)=2c(Cl-)
D. d����Һ��c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����( )
A.32g O2������ԭ����ĿΪNA
B.��״���£�11.2L H2O�к��е�ԭ����ĿΪ1.5 NA
C.2L 0.3mol/L��K2SO4��Һ��K+���ӵ����ʵ���Ũ��Ϊ1.2mol/L
D.�����£�05 NA���������ӵ����ʵ�����0.5mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com