
【题目】常温下,向10 mL 0.1 mol/L的CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)随滴入的Na2S溶液体积的变化如图所示(忽略滴加过程中的温度变化和溶液体积变化)。下列叙述正确的是( )
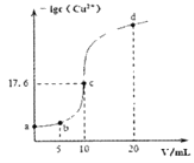
A. 常温下Ksp (CuS)的数量级为10-30
B. c点溶液中水的电离程度大于a点和d点溶液
C. b点溶液中c(Na+)=2c(Cl-)
D. d点溶液中c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+)
【答案】D
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,图中-lgc(Cu2+)越大,则c(Cu2+)越小,结合图中浓度计算溶度积常数及溶液中的守恒思想分析解答。
A.根据图像,V=10mL时,二者恰好完全反应生成CuS沉淀,CuSCu2++S2-,平衡时c(Cu2+)=c(S2-)=10-17.6mol/L,则Ksp(CuS)=c(Cu2+)c(S2-)=10-17.6mol/L×10-17.6mol/L=10-35.2mol2/L2,Ksp(CuS)的数量级为10-36,故A错误;
B.c点为NaCl溶液,对水的电离无影响,而a点为氯化铜溶液、d点为硫化钠溶液,都会发生水解反应促进水的电离,则c点溶液中水的电离程度小于a点和d点溶液,故B错误;
C.根据图像,b点时钠离子的物质的量为0.1mol/L×0.005L×2=0.001mol,氯离子的物质的量为0.1mol/L×0.01L×2=0.002mol,则c(Cl-)=2c(Na+),故C错误;
D.d点溶液中NaCl和Na2S的浓度之比为2:1,且溶液显碱性,因此c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+),故D正确;
答案选D。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】依据如图中氮元素及其化合物的转化关系,回答问题:
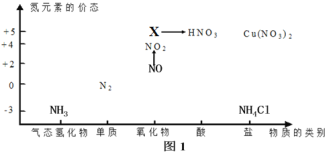
(1)图1中,X的化学式为________________;
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为:________________;
②下列试剂不能用于干燥NH3的是________________(填字母)。
A.浓硫酸B.碱石灰C.NaOH固体
③氨气是重要的化工原料,可以合成多种物质,写出催化氧化的化学方程式:________________;
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,发生的反应为:2NO+2CO![]() N2+2CO2该反应中,被氧化的物质是________________(填化学式),若反应中生成1molN2,则转移电子________________mol;
N2+2CO2该反应中,被氧化的物质是________________(填化学式),若反应中生成1molN2,则转移电子________________mol;
②NO→NO2的颜色变化是________________;
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:
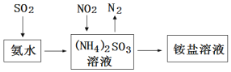
NO2被吸收过程的离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡唑类化合物是重要的医用中间体,如图是吡唑类物质L的合成路线。
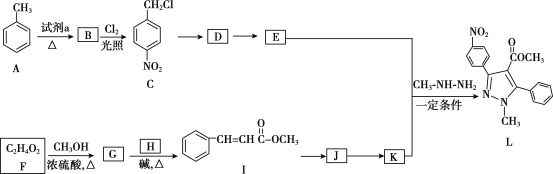
已知:R1—CHO+R2CH2—COOR3![]()
R1—CHO+R2NH2![]() R1—CH=N—R2
R1—CH=N—R2
(1)试剂a是__。
(2)C生成D的反应类型是__。
(3)D生成E的化学方程式是___。
(4)生成G的化学方程式是__。
(5)H的结构简式是__。
(6)写出符合下列条件的I的同分异构体的结构简式__。
a.是反式结构
b.能发生银镜反应
c.苯环上的一氯代物有2种
d.1mol该有机物能与2mol氢氧化钠反应
(7)K的分子式是C10H8O2,K的结构简式是__。
(8)以2-甲基丙烯和乙酸为原料,选用必要的无机试剂,合成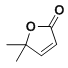 ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯的非金属性比氮的强,某同学依据反应3Cl2+2NH3=6HCl+N2进行实验证,设计的实验装置如下:
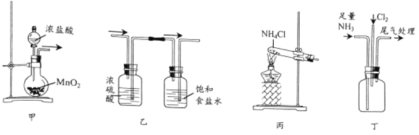
下列说法正确的是
A.可用图甲所示装置及药品制取Cl2B.可用图乙所示装置及气流方向净化Cl2
C.可用图丙所示装置及药品制取NH3D.可用图丁所示装置进行实验,瓶中有白烟产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A. 100 mL 1 mol·L-1FeCl3溶液中所含Fe3+的数目为0.1NA
B. 常温常压下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
D. 标准状况下,124 g P4中所含P—P键数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1molN≡N键断裂时,有6molN—H键断裂
D.单位时间内生成2amolNH3,同时消耗amolN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
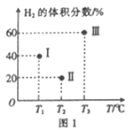
①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。(保留两位有效数字)
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中lgc(CO)/c(CO2)与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。
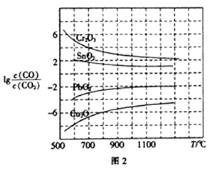
A.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
B.CO用于工业冶炼金属铬(Cr)时,还原效率不高
C.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
D.CO还原PbO2的反应△H>0
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
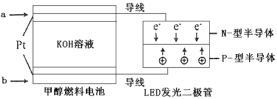
请写出加入(通入)a物质一极的电极反应式___________;每消耗6.4g甲醇转移的电子数为__________。
(5)一定条件下,用甲醇与一氧化碳反应合成乙酸可以消除一氧化碳污染。常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,若溶液呈中性,用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是
A. C2H5OH B. CH4 C. C2H4O D. C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
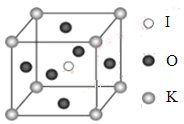
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com