
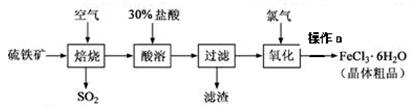
 种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验: 称量、__▲_____、转移、洗涤并转移、____▲____摇匀。
称量、__▲_____、转移、洗涤并转移、____▲____摇匀。 ”“偏高”“不变”)
”“偏高”“不变”) 质量;计算结晶水含量。请纠正实验过程中的两处错误;___▲_____;_____▲____。
质量;计算结晶水含量。请纠正实验过程中的两处错误;___▲_____;_____▲____。 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
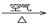 CuO
CuO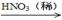 Cu(NO3)2
Cu(NO3)2 | A.40.32L | B.30.24L | C.20.16L | D.13.44L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
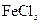 可用作印刷电路铜板腐蚀剂。
可用作印刷电路铜板腐蚀剂。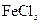 溶液腐蚀印刷电路铜板的离子方程式 。
溶液腐蚀印刷电路铜板的离子方程式 。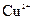 、
、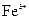 的浓度均为
的浓度均为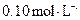 ,不考虑溶液体积的变化,则原
,不考虑溶液体积的变化,则原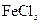 溶液的浓度为 。
溶液的浓度为 。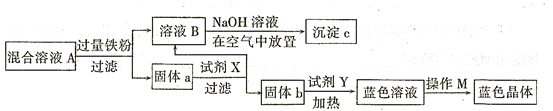
 的操作是
的操作是 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。| A.玻璃棒 | B.烧杯 | C.托盘天平 | D.500mL量筒 |
 溶液吸收,尾气中污染空气的气体为 (写化学式)。
溶液吸收,尾气中污染空气的气体为 (写化学式)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所得沉淀为0.05 mol的BaSO4 | B.混合气体中SO2的体积为0.448 L |
| C.a L混合气体的物质的量为0.04 mol | D.a的取值范围为0.672<a<0.896 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.56(3x+y)g | B.56(3x-y) g | C.28(3x+y)g | D.28(3x-y)g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com