

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
分析 (1)仪器A为球形干燥管;无水硫酸铜吸水效率太低,一般不用作干燥剂;
(2)实验的反应条件为:无水无氧且加热,应保证实验在无水无氧环境下进行;
(3)由于TiCl4遇潮湿空气产生白雾,发生水解反应,且反应在无氧条件下进行,故E装置作用是防止空气中水蒸气、氧气进入;A装置不能吸收空气中的氧气;
(4)反应得到气体TiCl4与二氧化碳,装置气密性要好,在加装药品之前应检验装置的气密性,之后要先通一会儿氮气,排除装置中的空气,再点燃酒精灯;
(5)制备结束后为防止热的TiCl4与空气中的成分发生变化,所以要继续通氮气至冷却;
(6)D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,分离互溶的液体采取蒸馏方法,CCl4的沸点为76℃,据此判断蒸馏需要的仪器和操作要点及控制的温度;
(7)根据反应方程式计算得TiCl4的理论产量,产率=$\frac{实际产量}{理论产量}$×100%,据此答题;
解答 解:(1)仪器A为球形干燥管;碱石灰、氧化钙、烧碱具有很强的吸水性,可以用于干燥氮气,而无水硫酸铜吸水效率太低,一般不用作干燥剂,
故答案为:球形干燥管;a;
(2)实验的反应条件为:无水无氧且加热,应保证实验在无水无氧环境下进行,而装置中有空气,通入氮气的目的是:排除装置中的空气,保证反应在无水无氧环境下进行,
故答案为:排除装置中的空气,保证反应在无水无氧环境下进行;
(3)由于TiCl4遇潮湿空气产生白雾,发生水解反应,且反应在无氧条件下进行,故E装置作用是防止空气中水蒸气、氧气进入,E中盛放的试剂为浓硫酸;A装置可以吸收水,但不能不能吸收空气中的氧气,不能保证反应在无氧环境下进,故E装置不能换成A装置,
故答案为:浓硫酸;防止空气中水蒸气、氧气进入;不能;A装置不能吸收空气中的氧气,不能保证反应在无氧环境下进;
(4)反应得到气体TiCl4与二氧化碳,装置气密性要好,在加装药品之前应检验装置的气密性,之后要先通一会儿氮气,排除装置中的空气,再点燃酒精灯,
故答案为:检查装置的气密性;通一会儿氮气;
(5)制备结束后为防止热的TiCl4与空气中的成分发生变化,所以要继续通氮气至冷却,故操作顺序为,熄灭酒精灯、冷却至室温、停止通N2,
故选c;
(6)D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,分离互溶的液体采取蒸馏方法,CCl4的沸点为76℃,所以蒸馏时温度控制在76℃,不需要用球形冷凝管,用直形冷凝管即可,故选d,蒸馏时温度计的水银球应插在蒸馏烧瓶的支管口附近,
故答案为:蒸馏;d;76℃;蒸馏烧瓶的支管口附近;
(7)设TiCl4的理论产量为x,根据反应方程式TiO2(s)+CCl4(g) $\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),
48+32 48+142
8.0g x
x=$\frac{8.0×(48+142)}{80}$g=19.0g
所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{9.5g}{19g}$×100%=50%,
故答案为:b.
点评 本题考查实验制备方案,明确原理是解题关键,侧重考查学生装置的分析评价和计算能力,注意对题目信息的提取与应用,是对学生综合能力的考查,难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的反应和实验装置如下:
氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的反应和实验装置如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
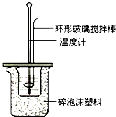 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  | 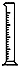 |
| 序号 | a | b | c | d | e | f |
 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4和浓HCl在空气中敞口放置时浓度均减小 | |
| B. | SO2和Cl2均能使品红溶液褪色 | |
| C. | 浓H2SO4和稀硫酸与锌反应均生成气体 | |
| D. | 浓H2SO4、浓HNO3均可以用铁制容器贮存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com