
【题目】下列有关物质分类或归类中,正确的是
①混合物:盐酸、漂白粉、氯水、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、生石膏、冰醋酸、氯化银
④同素异形体:C60、C70、金刚石、石墨
A.①③ B.②③ C.③④ D.④
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】下图是实验室进行氯气的制备及性质实验的组合装置,部分固定装置未画出。
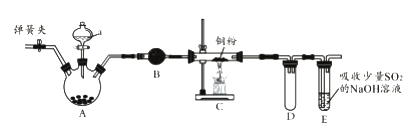
(1)A中固体是氯酸钾,液体a是浓盐酸,写出该反应的化学方程式:_________________。
(2)B为干燥装置,加入的固体是_________________;欲净化氯气,A、B间应添加一个盛有_________________的洗气瓶。
(3)C中的反应现象是_________________;D的作用是_________________。
(4)已知E中发生的反应为:Cl2+Na2SO3+2NaOH![]() 2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。
2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。
a.甲同学认为该吸收液中ClO-和SO32-不能同时存在,其理由是_________________(用离子方程式表示)。
b.乙同学为了检验吸收液中是否含有SO32-,取少量吸收液于试管中,加适量稀硫酸酸化后,滴加品红溶液,发现品红溶液褪色。据此推断该吸收液中一定有SO32-。乙同学的推断是否正确?________________(填“正确”或“不正确”),理由是_________________。
c.请设计实验检验吸收液中是否含有ClO-_______________(写出实验步骤、现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不符合节能减排的是( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的说法正确的是
A. 钠在空气中燃烧生成淡黄色的Na2O
B. 铝和氢氧化钠溶液反应生成Al(OH)3和H2O
C. 铁在高温下与水蒸气反应生成Fe3O4和H2
D. 铝、铁、铜在潮湿的空气中生锈均生成对应的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者小于后者的是
①C(s)+![]() O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
②S(g)+O2(g)═SO2(g)△H3;S(s)+O2(g)═SO2(g)△H4
③CaO(s)+H2O(l)═Ca(OH)2(s)△H5;CaCO3(s)═CaO(s)+CO2(g)△H6
A.② B.①② C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4通常用作火箭的高能燃料,N2O4作氧化剂。请回答下列问题:
(1)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+a kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-b kJ/mol
2NO2(g)N2O4(g) ΔH=-c kJ/mol
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式__________________。
(2) N2、H2合成氨气为放热反应。800 K时向下列起始体积相同的密闭容器中充入2molN2、3molH2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙是绝热容器,三容器各自建立化学平衡。

①达到平衡时,平衡常数K甲__________K乙__________K丙(填“>”、“<”或“=”)。
②达到平衡时N2的浓度c(N2)甲__________c(N2)乙,c(N2)乙__________c(N2)丙(填“>”、“<”或“=”)。
③对甲、乙、丙三容器的描述,以下说法正确的是__________。
A.乙容器气体密度不再变化时,说明此反应已达到平衡状态
B.在甲中充入稀有气体He,化学反应速率加快
C.向甲容器中充入氨气,正向速率减小,逆向速率增大
D.丙容器温度不再变化时说明已达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+48.0kJ·mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) △H=-192.9kJ·mol-1
下列说法正确的是

A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(1)+![]() O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的转化。在转化的各阶段被破坏的粒子间的主要相互作用依次是
A.氢键;分子间作用力;非极性键
B.氢键;氢键;极性键[
C.氢键;极性键;分子间作用力
D.分子间作用力;氢键;非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
资料:氰化钠化学式NaCN(N元素-3价),白色结晶颗粒,剧毒,易溶于水
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式________________。
(2)某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过下图装置制备Na2S2O3。
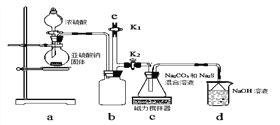
①a装置中盛浓硫酸的仪器名称是_______________;
b装置的作用是________________。
②c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有___________________。
③实验结束后,在e处最好连接盛_________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,目的是__________________
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
① 废水中氰化钠的最高排放标准为0.50 mg/L。
② Ag++2CN- = [ Ag (CN)2]-, Ag++I- = AgI↓, AgI呈黄色,且CN-优先与Ag+反应。
实验如下:
取25.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50 mL。
④滴定终点的判断方法是____________________
⑤处理后的废水中氰化钠的含量为__________mg/L,_______(选填“能”、“不能”)排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com