
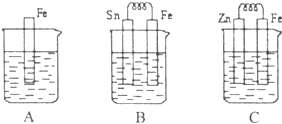
 I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:物理教研室 题型:013
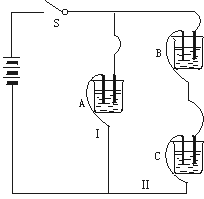
若撤去B,测知电流IA![]() IC;
IC;
若撤去C,并将A、B两溶液混匀后分为两等份,再置于电路Ⅰ、Ⅱ处,测知通过A、B混合溶液的电流与先前通过A溶液的电流的相对大小关系为IAB![]() IA,已知A、B、C分别选自下列溶液:0.1
mol·L-1盐酸、0.1
mol·L-1醋酸、0.1
mol·L-1 NaCl溶液、0.1
mol·L-1硫酸、0.1
mol·L-1 NaOH溶液、0.1
mol·L-1氨水.25℃时,A溶液pH<7.
IA,已知A、B、C分别选自下列溶液:0.1
mol·L-1盐酸、0.1
mol·L-1醋酸、0.1
mol·L-1 NaCl溶液、0.1
mol·L-1硫酸、0.1
mol·L-1 NaOH溶液、0.1
mol·L-1氨水.25℃时,A溶液pH<7.
回答下列问题:
(1)指出A、B、C是(或可能是)什么溶液?
A:______________;B:______________;C:______________.
(2)若向C溶液中滴入酚酞试剂呈红色,则C是______________;将A、B、C分别以等体积进行两两混合,结果是哪种组合的混合液中水的电离程度最大?(选填A、B、C回答).
查看答案和解析>>
科目:高中化学 来源: 题型:022
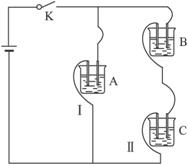
有A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,并按下图所示方式在电路中连接。闭合开关K后,测得各支路电流强度I1≈IⅡ(其中IⅡ 略小)。若撤去B,测知电流强度IA《Ic;若撒去C,并将A、B两溶液混匀后均分为 两等份,再重置于电路I、Ⅱ处,测知通过A、B混合溶液的电流强度与先前通过A 溶液的电流强度的相对大小关系为:1AB》IA。已知A、B、C分别选自下列溶液:0.1mol·L-1盐酸、0.1mol·L-1醋酸、0.1mol·L-1NaCl 溶液、0.1mol·L-1硫酸、0.1mol·L-1NaOH溶液、 0.1mol·L-1氨水,且25℃时A溶液PH<7。
(1)指出A、B、C是(或可能是)什么溶液?A________; B________;C________。
(2)若向C溶液中滴入酚酞试剂呈红色,则C是________;将A、B、C分别以等体 积进行两两混合,结果是哪种组合的混合液中,水的电离度最大?(填“A”“B”或“C”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C分别选自下列溶液:0.1 mol·L-1盐酸、0.1 mol·L-1醋酸、0.1 mol·L-1 NaCl溶液、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1氨水。且25 ℃时,A溶液pH<7。
完成下列问题:
(1)指出A、B、C是(或可能是)什么溶液?A.________;B.________;C.________。
(2)若向C溶液中滴入酚酞试剂呈红色,则C是________;将A、B、C分别以等体积进行两两混合,结果是哪种组合的混合液中,水的电离程度最大?________(选填A、B、C回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C分别选自下列溶液:0.1 mol·L-1盐酸、0.1 mol·L-1醋酸、0.1 mol·L-1 NaCl溶液、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1氨水。且25 ℃时,A溶液pH<7。
完成下列问题:
(1)指出A、B、C是(或可能是)什么溶液?
A.______________;B.______________;C.______________。
(2)若向C溶液中滴入酚酞试剂呈红色,则C是________;将A、B、C分别以等体积进行两两混合,结果是________组合的混合液中,水的电离程度最大(选填A、B、C回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
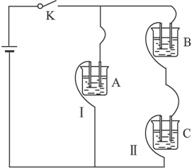
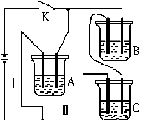
有A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,如图所示,在电路中连接开关K后,测得各支路电流强度IⅠ=IⅡ(其中IⅡ略小)。若撤去B,测得IA IC。若撤去C,并将A、B两溶液混合,混合溶液的电流强度与先前通过A的大小关系为IAB
IC。若撤去C,并将A、B两溶液混合,混合溶液的电流强度与先前通过A的大小关系为IAB  IA。
IA。
已知A、B、C分别选自下列溶液:0.1mol?L-1盐酸、0.1mol?L-1醋酸、0.1mol?L-1NaCl溶液、0.1mol?L-1硫酸、0.1mol?L-1氢氧化钠溶液、0.1mol?L-1氨水,且25℃时,A溶液pH<7,回答下列问题:
(1)指出A、B、C是(或可能是)什么溶液(写溶质化学式):
A________,B________,C________。
(2)A、B、C三种溶液的电阻的大小关系为______,由此可见电解质溶液中的电阻大小与______________有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com