
【题目】除去SiO2中混有的少量生石灰和石灰石,有如下操作:①加水溶解 ②加水煮沸③过滤 ④加稀HCl ⑤加稀H2SO4,正确的操作顺序是
A.①③B.④③C.⑤③D.②③
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】生理盐水是溶质质量分数为0.9%的氯化钠溶液,现用1000g生理盐水给某病人输液,进入病人体内的氯化钠的质量为( )
A.0.9gB.9gC.90gD.18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,X与M同主族,Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。清回答下列问题:
(1)Q的元素符号为______,Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)_______。
(2)Y在元素周期表中的位置为_______________,Y与硫元素形成的二元化合物的电子式为_________________________。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)_____________。
(4)单质Y和元素Z的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为_________。
(5)Z和G组成的化合物GZ,被大量用于制造电子元件。工业上用G的氧化物、Y单质和Z单质在高温下制备GZ,其中G的氧化物和Y单质的物质的量之比为1∶3,则该反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是( )
A. 常温常压下,20.0 g重水(D2O)所含的中子数约为6.02×1023
B. 室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C. 通常状况下,1 mol的NO2与N2O4混合气体变为标准状况时其分子数约为6.02×1023
D. 常温下,7.1 g Cl2与足量NaOH溶液反应转移的电子数约为0.2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。经质谱法测得该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗O2的质量是多少______?
(2)求此化合物的分子式______。
(3)经红外光谱分析,该化合物分子中存在苯环和羟基,试写出其可能的结构简式______。
(4)进一步实验表明,该化合物的核磁共振氢谱存在四个峰,且峰面积之比为1:2:2:3,试确定该化合物的结构简式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,VL氨气溶解在1L水中(水的密度近似为lg/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ρ=![]() B. ω=
B. ω=![]() C. ω=
C. ω=![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
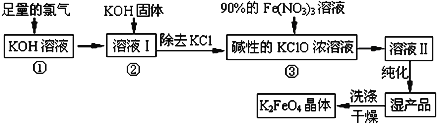
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2 =5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)的情况下进行;
(2)在溶液I中加入KOH固体的目的是________(填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为________________________________________ 。
(4)如何判断K2FeO4晶体已经洗涤干净________________________________。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com