
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述中,正确的说法有几项( )
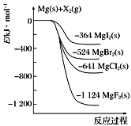
①Mg(s)所具有的能量高于MgX2(s)所具有的能量
②MgCl2电解制Mg(s)和Cl2(g)是吸热过程
③热稳定性:MgI2>MgBr2>MgCl2>MgF2
④断裂Mg(s)和X2(g)的化学键放出的能量比形成MgX2(s)的化学键吸收的能量多
A.1项B.2项C.3项D.4项
【答案】A
【解析】
①根据图像可知,Mg(s)与X2(g)的能量高于MgX2(s),但Mg(s)所具有的能量不一定高于MgX2(s)所具有的能量,①错误;
②MgCl2(s)的能量低于Mg(s)与Cl2(g),所以依据能量守恒判断由MgCl2制取Mg的反应是吸热反应,②正确;
③物质的能量越低越稳定,根据图象数据分析,化合物的热稳定性顺序为:MgI2<MgBr2<MgCl2<MgF2,③错误;
④根据图像可知,Mg(s)与X2(g)的能量高于MgX2(s),说明反应放热,断裂Mg(s)和X2(g)的化学键吸收的能量比形成MgX2(s)的化学键释放的能量少,④错误;
综合以上分析,只有②正确,答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+3H2(g) ![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. N2、H2和NH3的质量分数不再改变
B. c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C. 断裂1 mol N≡N键的同时,形成6 mol N—H键
D. N2与H2的物质的量之和是NH3的物质的量的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)图中表示NO2的变化的曲线是___(填字母);
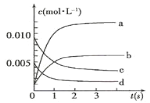
(2)800℃,反应达到平衡时,NO的转化率是___ ;
(3)用O2表示从0~2s内该反应的平均速率v=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂,有机合成中氯化的催化剂等。某学习小组设计了如图所示的装置(夹持和加热仪器省略)制备无水四氯化锡。反应原理是Sn+2Cl2=SnCl4。
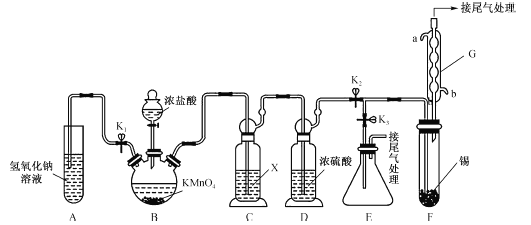
已知:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 247 | -33 |
沸点/℃ | 623 | 114 |
其他性质 | 无色晶体,易被氧化 | 无色液体,易水解 |
请回答下列问题:
(1)装置G的名称为__________,该装置的进水口为__________(填“a”或“b”)。
(2)装置B中发生反应的离子方程式为__________。
(3)装置C的作用是除去氯化氢,所用试剂X的名称是_________。
(4)按图连接好装置,检查装置气密性,关闭K1、K3,打开K2,慢慢滴入浓盐酸,待观察到装置F内充满黄绿色气体后,开始加热装置F,当装置F中的固体完全消失,充满SnCl4气体时,将生成的SnCl4排入接收器E中的操作是:停止加热装置F,关闭分液漏斗活塞,__________,再用洗耳球从G的上出口向装置内吹气。
(5)某同学认为装置F中的反应可能产生SnCl2杂质。下列试剂中,可用于检测反应是否产生了SnCl2的有__________(填字母)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 c.溴水 d.AgNO3溶液
(6)SnCl4能溶解一定量的氯气,若制取3 kg SnCl4(含氯气的质量分数为13.0%,假设不含除氯气外的其他杂质),则至少需通入氯气的体积(标准状况下)是__________m3(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,t℃时发生反应:N2(g)+3H2(g)2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第4min时,N2的转化率为___;
(2)用H2表示从0~2min内该反应的平均速率v(H2)=___;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为__。(用字母填空,下同);
a.v(NH3)=0.04mol·L-1·min-1 b.v(H2)=0.03mol·L-1·min-1
c.v(N2)=0.03mol·L-1·min-1 d.v(H2)=0.00lmol·L-1·s-1
(4)平衡时容器内气体的压强与起始时比__(填“变大”,“变小”或“相等”下同),混合气体的密度与起始时比___。
(5)将amolN2与bmolH2的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(N2)=n(H2)=2n(NH3),则原混合气体中a:b=___。
(6)下列表述能作为反应达到化学平衡状态的标志是__。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成nmolN2的同时,生成3nmolH2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3molH—H键断裂的同时2molN—H键也断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
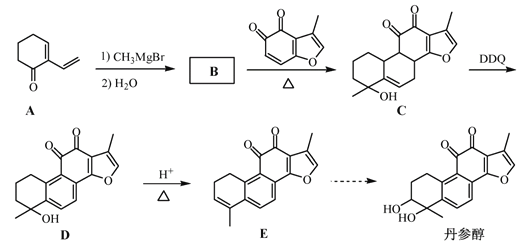
已知: 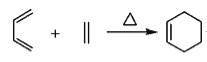
(1)C中的含氧官能团名称为羟基、_____和______。
(2)D![]() E的反应类型为__________________。
E的反应类型为__________________。
(3)B的分子式为C9H14O,写出B的结构简式:__________________。
(4)写出以![]() 和
和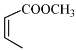 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)________________。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碱金属元素原子最外层的电子都是_______个,在化学反应中它们容易失去_______个电子;卤族原子最外层的电子都是_______个,在化学反应中它们得到_______个电子。
(2)用电子式表示:N2_____________,CH4__________________,KCl_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气味。上述物质的转化关系如图所示。下列说法错误的是
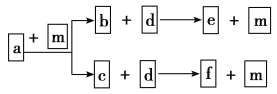
A.简单离子半径:Z<YB.阴离子的还原性:Y>W
C.简单气态氢化物的热稳定性:Y>XD.W、Y、Z形成的化合物含有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com