
【题目】在2L密闭容器内,t℃时发生反应:N2(g)+3H2(g)2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第4min时,N2的转化率为___;
(2)用H2表示从0~2min内该反应的平均速率v(H2)=___;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为__。(用字母填空,下同);
a.v(NH3)=0.04mol·L-1·min-1 b.v(H2)=0.03mol·L-1·min-1
c.v(N2)=0.03mol·L-1·min-1 d.v(H2)=0.00lmol·L-1·s-1
(4)平衡时容器内气体的压强与起始时比__(填“变大”,“变小”或“相等”下同),混合气体的密度与起始时比___。
(5)将amolN2与bmolH2的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(N2)=n(H2)=2n(NH3),则原混合气体中a:b=___。
(6)下列表述能作为反应达到化学平衡状态的标志是__。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成nmolN2的同时,生成3nmolH2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3molH—H键断裂的同时2molN—H键也断裂
【答案】70% 0.09mol/(L·min) c>a=d>b 变小 不变 5:7 bc
【解析】
N2的初始物质的量0.20mol,第4min时,N2的物质的量为0.06mol,根据转化率公式,转化率=![]() ×100%计算。根据平均速率v(N2)=
×100%计算。根据平均速率v(N2)=![]() ,v(H2)=3v(N2)计算。同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比;根据化学反应速率与计量数的比值大小,从而确定选项,注意单位是否相同;平衡时容器内气体的压强之比等于物质的量之比,根据密度
,v(H2)=3v(N2)计算。同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比;根据化学反应速率与计量数的比值大小,从而确定选项,注意单位是否相同;平衡时容器内气体的压强之比等于物质的量之比,根据密度![]() 进行判断。根据三段式进行判断。根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
进行判断。根据三段式进行判断。根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
(1)上述反应在第4min时,N2的转化率为![]() ;
;
(2)用H2表示从0~2min内该反应的平均速率,根据平均速率v(N2)= ,根据化学反应速率之比等于化学计量数之比,v(H2)=3v(N2),v(H2)=3×0.03mol/(L·min) =0.09mol/(L·min);
,根据化学反应速率之比等于化学计量数之比,v(H2)=3v(N2),v(H2)=3×0.03mol/(L·min) =0.09mol/(L·min);
(3)用各物质的化学反应速率除以化学计量数得到的数值越大,速率越快; a.![]() ;
;
b.![]() ;
;
c.v(N2)=![]() ;
;
d.v(H2)=![]() ;
;
得到该反应进行快慢的顺序为c>a=d>b;
(4) 根据化学反应,N2(g)+3H2(g)2NH3(g),假设氢气的起始物质的量为amol,
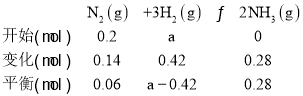
起始物质的量为(0.2+a)mol,平衡时的物质的量为(0.06+a-0.42+0.28)mol=(a-0.08) mol,(0.2+a)>(a-0.08),气体的压强与物质的量成正比,平衡时容器内气体的压强与物质的量变小;混合气体的密度![]() ,质量是不变的,容器的体积也是不变的,故混合气体的密度是不变的;
,质量是不变的,容器的体积也是不变的,故混合气体的密度是不变的;
(5)将amolN2与bmolH2的混合气体发生上述反应,
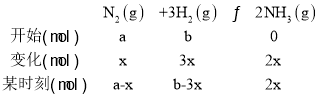
n(N2)=n(H2)=2n(NH3),即a-x=b-3x=4x,解得: a:b=5:7;
(6) a.反应速率之比等于化学计量数之比,无论是否达到平衡状态都存在反应速率v(N2):v(H2):v(NH3)=1:3:2,不能用于判断是否破坏,故a错误;
b.各组分的物质的量浓度不再改变,可说明正逆反应速率相等,达到破坏状态,故b正确;
c.混合气体的平均相对分子质量不再改变,说明气体的总物质的量不变,可说明达到破坏状态,故c正确;
d.因气体的质量不变,容器的体积不变,则无论是否达到破坏,混合气体的密度都不变,故d错误;
e.单位时间内生成nmolN2的同时,生成3nmolH2,都为逆反应,不能说明正逆反应速率相等,故e错误;
f.2v(N2)消耗=v(NH3)消耗,说明正逆反应速率相等,v(N2)消耗=2v(NH3)消耗,不能说明正逆反应速率相等,故f错误;
g.单位时间内3molHH键断裂的同时2molNH键也断裂,正逆反应速率不等,没有达到破坏状态,故g错误;
答案选


科目:高中化学 来源: 题型:
【题目】已知有机物 A、B、C、D、E、F、G 有如下转化关系,其中 C 的产量可用来衡量一个国家的石油化工发展水平,G 的分子式为 C9H10O2,试回答下列有关问题。
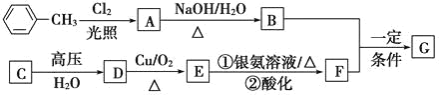
(1)G 的结构简式为_______。
(2)指出下列反应类型:B+F→G_________,
(3)写出下列反应的化学方程式:A→B:________________
(4)符合下列条件的 G 的同分异构体有____种
①苯环上有 3 个取代基,且有两个取代基相同;
②能够与新制的银氨溶液反应产生光亮的银镜。
其中共有四种不同化学环境氢原子的同分异构体的结构简式为__________、___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是
A. 化合物YX4W溶于水后,得到的溶液呈碱性
B. 化合物YW3为共价化合物,电子式为![]()
C. Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D. 原子半径大小:W>Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯与一卤代烷在催化剂作用下可生成苯的同系物:![]() +CH3X→
+CH3X→![]() +HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
+HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
A.CH2=CH2和HClB.CH3CH3和I2
C.CH2=CH2和Cl2D.CH3CH3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述中,正确的说法有几项( )
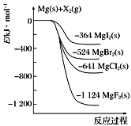
①Mg(s)所具有的能量高于MgX2(s)所具有的能量
②MgCl2电解制Mg(s)和Cl2(g)是吸热过程
③热稳定性:MgI2>MgBr2>MgCl2>MgF2
④断裂Mg(s)和X2(g)的化学键放出的能量比形成MgX2(s)的化学键吸收的能量多
A.1项B.2项C.3项D.4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应使用催化剂后,其反应过程中能量变化如图。下列说法错误的是
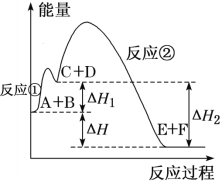
A.任何化学反应都伴随着能量的变化,能量变化主要是以热能的形式体现
B.总反应为反应物的总能量高于生成物总能量的反应,但反应①是吸热反应,
C.使用催化剂后,总反应的反应热不变、活化能减小
D.ΔH=ΔH2-ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(1)C-的电子式___。
(2)A+、B2-、F3+离子半径由大到小的顺序为___(用离子符号表示)。
(3)含F3+的溶液中通入过量D,反应的离子方程式是___。
(4)A单质与E反应的离子方程式为___,生成的化合物中化学键的类型是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示反应X(g)![]() 4Y(g) +Z(g) △H< 0,在某温度时X的浓度随时间变化的曲线:
4Y(g) +Z(g) △H< 0,在某温度时X的浓度随时间变化的曲线:

下列有关该反应的描述正确的是( )
A. 第6min后,反应就终止了
B. X的平衡转化率为85%
C. 若升高温度,X的平衡转化率将大于85%
D. 若降低温度,v正和v逆将以同样倍数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的氢化物是广泛的化工原料,回答下列问题:
(1)工业上合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。
2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。

①氨分解:2NH3(g)![]() N2(g)+3H2(g)的活化能为_________kJ/mol
N2(g)+3H2(g)的活化能为_________kJ/mol
②合成氨时加入铁粉可以加快生成NH3的速率,在图I中画出加入铁粉后的能量变化曲线。_______
(2)联氨作火箭燃料的反应为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H1
已知:2O2(g)+N2(g)=N2O4(1) △H2 N2H4(1)+O2(g)=N2(g)+2H2O(g) △H3
上述热效应之间的关系式为△H1=____。某新型火箭用液氧/煤油代替联氨/N2O4,这种替换可能的好处是___(一条即可)。
(3)天然气制氢气是工业上制氢气的主要方法之一,其主要反应如下:
i.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
ii.CO(g)+ H2O(g)![]() CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
在一定温度下,2L的密闭容器中加入a molCH4和2amolH2O发生反应,t min时反应达平衡,测得容器内CObmol、CO2cmol。回答下列问题:
①下列可判断体系达到平衡状态的是_______。
A.CO的体积分数不变 B.容器内气体密度不变 C.3v(CH4)=v(H2) D.![]() 不再变化
不再变化
②0~tmin反应速率v(CO2)=_____,CH4的的转化率为_____,反应ⅱ的平衡常数K=______。
③图Ⅱ中T℃之后c(CO2)随温度升高而减小的原因是_________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com