
【题目】已知有机物 A、B、C、D、E、F、G 有如下转化关系,其中 C 的产量可用来衡量一个国家的石油化工发展水平,G 的分子式为 C9H10O2,试回答下列有关问题。
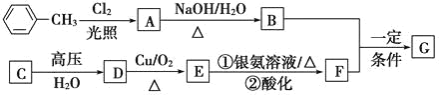
(1)G 的结构简式为_______。
(2)指出下列反应类型:B+F→G_________,
(3)写出下列反应的化学方程式:A→B:________________
(4)符合下列条件的 G 的同分异构体有____种
①苯环上有 3 个取代基,且有两个取代基相同;
②能够与新制的银氨溶液反应产生光亮的银镜。
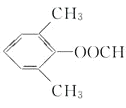
其中共有四种不同化学环境氢原子的同分异构体的结构简式为__________、___________
【答案】![]() 酯化(取代)反应
酯化(取代)反应 ![]() +NaOH
+NaOH![]()
![]() +NaCl 6
+NaCl 6 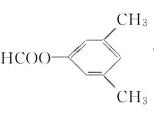
【解析】
C的产量可用来衡量一个国家的石油化工发展水平,则C为CH2=CH2,C与水发生加成反应生成的D为CH3CH2OH,D发生催化氧化反应生成的E为CH3CHO,E与银氨溶液发生银镜反应后酸化生成的F为CH3COOH,甲苯与氯气在光照条件发生甲基上的取代反应生成A,A发生水解反应生成B,B与F反应生成G(C9H10O2),由G的分子式可知,B为一元醇,故A为![]() ,B为
,B为![]() ,G为
,G为![]() ,据此解答。
,据此解答。
C的产量可用来衡量一个国家的石油化工发展水平,则C为CH2=CH2,C与水发生加成反应生成的D为CH3CH2OH,D发生催化氧化反应生成的E为CH3CHO,E与银氨溶液发生银镜反应后酸化生成的F为CH3COOH,甲苯与氯气在光照条件发生甲基上的取代反应生成A,A发生水解反应生成B,B与F反应生成G(C9H10O2),由G的分子式可知,B为一元醇,故A为![]() ,B为
,B为![]() ,G为
,G为![]() ;
;
(1)G的结构简式为![]() ;
;
(2)![]() 与CH3COOH发生酯化反应生成G,则反应类型为酯化(或取代)反应;
与CH3COOH发生酯化反应生成G,则反应类型为酯化(或取代)反应;
(3)A→B是![]() 在NaOH溶液中发生水解反应,则反应的化学方程式为
在NaOH溶液中发生水解反应,则反应的化学方程式为![]() +NaOH
+NaOH![]()
![]() +NaCl;
+NaCl;
(4)符合下列条件的![]() 的同分异构体:苯环上有3
的同分异构体:苯环上有3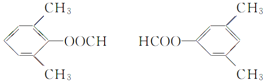 。
。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】天然海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电时燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:下列说法错误的是( )

A.天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种有机物的结构简式如下图所示,下列说法不正确的是
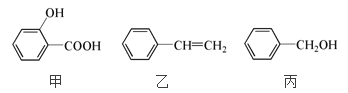
A. 乙能使溴水褪色,但不存在顺反异构体
B. 甲能与浓溴水反应,说明苯环使羟基变活泼
C. 甲、乙、丙都能发生加成反应,取代反应
D. 甲和丙不属于同系物,可用过量的饱和溴水鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解Na2CO3溶液的工作原理如图所示。下列说法错误的是
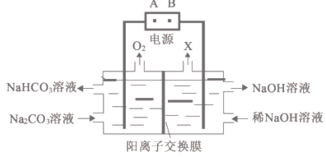
A.A为电源的正极
B.X为氢气
C.工作时,Na+向左室迁移
D.阳极的电极反应式为4CO32-+2H2O-4e-=4HCO3-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+3H2(g) ![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. N2、H2和NH3的质量分数不再改变
B. c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C. 断裂1 mol N≡N键的同时,形成6 mol N—H键
D. N2与H2的物质的量之和是NH3的物质的量的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是火箭的固体燃料,发生反应为2NH4ClO4![]() N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
A.1 mol NH4ClO4溶于水含NH4+和ClO4-离子数均为NA
B.产生6.4g O2反应转移的电子总数为1.4NA
C.反应中还原产物分子数与氧化产物分子总数之比为3:1
D.0.5mol NH4ClO4分解产生的气体体积为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1273K、100.0kPa条件下,乙烷生成乙烯的反应C2 H6(g)![]() C2 H4(g)+H2(g)达到平衡后
C2 H4(g)+H2(g)达到平衡后
A. C2 H6的浓度保持不变
B. C2 H6仍在不断分解,其浓度不断减小
C. C2 H6的分解速率大于生成速率
D. C2 H4仍在不断生成,其浓度不断增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示:
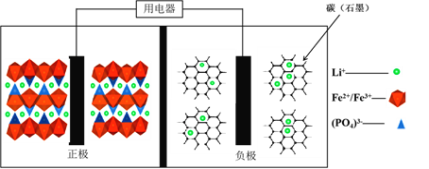
原理如下:(1 x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法不正确的是
LiFePO4+nC。下列说法不正确的是
A.放电时,电子由负极经导线、用电器、导线到正极
B.充电时,Li+向左移动
C.充电时,阴极电极反应式:xLi++xe +nC=LixCn
D.放电时,正极电极反应式:xFePO4+xLi++xe =xLiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,t℃时发生反应:N2(g)+3H2(g)2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第4min时,N2的转化率为___;
(2)用H2表示从0~2min内该反应的平均速率v(H2)=___;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为__。(用字母填空,下同);
a.v(NH3)=0.04mol·L-1·min-1 b.v(H2)=0.03mol·L-1·min-1
c.v(N2)=0.03mol·L-1·min-1 d.v(H2)=0.00lmol·L-1·s-1
(4)平衡时容器内气体的压强与起始时比__(填“变大”,“变小”或“相等”下同),混合气体的密度与起始时比___。
(5)将amolN2与bmolH2的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(N2)=n(H2)=2n(NH3),则原混合气体中a:b=___。
(6)下列表述能作为反应达到化学平衡状态的标志是__。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成nmolN2的同时,生成3nmolH2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3molH—H键断裂的同时2molN—H键也断裂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com