
【题目】天然海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电时燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:下列说法错误的是( )

A.天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
【答案】D
【解析】
火力发电时燃煤排放的含SO2的烟气通入吸收塔和天然海水,得到溶液通入氧气氧化亚硫酸生成硫酸,加入天然海水中和、稀释经氧化后海水中生成的酸。
A.海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO-3等离子,在这些离子中能发生水解的是CO32-、HCO-3离子,CO32-+H2OHCO3-+OH-,HCO3-+H2OH2CO3+OH-它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,故A正确;
B.天然海水吸收了含硫烟气后,要用O2进行氧化处理,因为氧气具有氧化性,被氧化的硫元素的化合价为+4价,具有还原性,所以氧气将H2SO3、HSO3-、SO32-等氧化为硫酸,如亚硫酸被氧化的反应为2H2SO3+O2=2H2SO4,故B正确;
C.氧化后的“海水”需要用大量的天然海水与之混合后才能排放,是因中和稀释经氧气氧化后海水中生成的酸(H+),故C正确;
D.从框图可知:排放”出来的海水,是经过加天然海水中和、稀释经氧化后海水中生成的酸后排放的,溶液的体积显然比进入吸收塔的天然海水大,所以SO42-的物质的量浓度排放出来的海水中浓度小,故D错误;
故答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
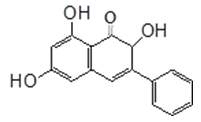
A.高良姜素的分子式为C15H15O5
B.高良姜素分子中含有3个羟基、8个双键
C.高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应
D.1mol高良姜素与足量的钠反应生成33.6LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列反应属于吸热反应的是_________________________
①铝粉与氧化铁粉末反应 ②酸碱中和反应 ③硝酸铵溶于水 ④碳酸钙分解 ⑤H2在Cl2中燃烧 ⑥灼热的碳与CO2的反应 ⑦NH4Cl晶体与Ba(OH)28H2O混合搅拌
(2)在25℃、101kPa的条件下,断裂1mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1mol H—Cl键放出431 kJ能量。该条件下H2+Cl2=2HCl反应中的能量变化可用如图表示:
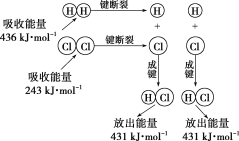
现有1 mol H2和1 mol Cl2在25℃、101 kPa下完全反应。请根据上述信息回答下列有关问题:
①该反应的热化学方程式为_____________
②反应物的总能量___________(填“>”或“<”)生成物的总能量。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。如图所示:

1 mol CH4完全燃烧生成气态水的能量变化和1 mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式____________。
(4)几种含硅元素的物质之间的相互转化关系如图所示:
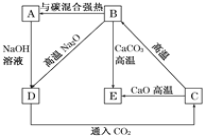
①写出下列反应的化学方程式:
B→A:_________;
B→E:_________。
②写出下列溶液中反应的离子方程式:D→C_________。
(5)Mg6Si4O10(OH)8用氧化物的形式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由一氧化氮与氯气在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点是-64.5℃,沸点是-5.5℃,遇水易水解。回答下列问题:
(1)实验室制备原料气NO和Cl2的装置如下图所示。

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为______________。
②实验室制Cl2时,装置B的作用是______________________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
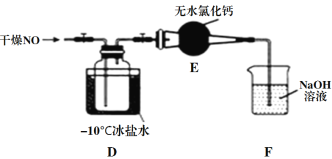
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_____________。
②装置D中的现象为_____________________________________________。
③装置E中无水氯化钙的作用为_______________________________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要的化工原料。
(1)已知: N2(g)+O2(g)=2NO(g) △H= +180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H= -905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H= -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:_____________________;如果在1 L密闭容器中,3mol NH3在等温条件下充分反应,2min后达到平衡,平衡时吸收的热量为92.4 kJ ,则在这段时间内v(H2)=___________________;保持温度不变,将起始NH3的物质的量调整为8 mol,平衡时NH3的转化率为_________________。
(2)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:___________________,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是_____________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________________________。
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是____________(填字母代号)。
4NO(g)+6H2O(g) △H<0。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是____________(填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(4)如果某氨水的电离程度为1%,向浓度为0.01 mol/L MgCl2溶液中滴加氨水,则开始产生沉淀时(忽略溶液体积变化)溶液中的NH3·H2O的浓度为______________(已知Ksp[Mg(OH)2]=4.010-12])。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的结构陶瓷材料,属于新型功能性陶瓷产品,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃时反应获得。
(1)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式:_________。
(2)现用四氧化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅及氯化氢,反应的化学方程式为____。
(3)沸石是一种含结晶水的、具有多孔结构的铝硅酸盐,化学式为Na2[Al2Si3O10(H2O)2],若以氧化物形式可表示为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质结构、性质的说法中正确的是( )

①烃的密度比水的密度小
②C2H6、C4H10、C6H14在常温下均为气体
③1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有3个碳碳双键
④水芹烯(桂皮中的一种成分)键线式如图,其分子式为C10H16
⑤![]() 互为同系物
互为同系物
⑥甲烷与氯气在光照的条件下可以制取纯净的一氯甲烷
⑦C5H12有三种同分异构体
A. ①②⑤ B. ③④⑦ C. ③⑤⑥ D. ①④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
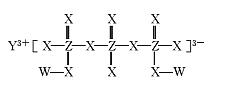
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物 A、B、C、D、E、F、G 有如下转化关系,其中 C 的产量可用来衡量一个国家的石油化工发展水平,G 的分子式为 C9H10O2,试回答下列有关问题。
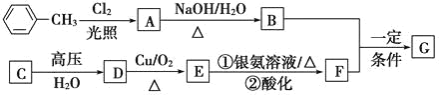
(1)G 的结构简式为_______。
(2)指出下列反应类型:B+F→G_________,
(3)写出下列反应的化学方程式:A→B:________________
(4)符合下列条件的 G 的同分异构体有____种
①苯环上有 3 个取代基,且有两个取代基相同;
②能够与新制的银氨溶液反应产生光亮的银镜。
其中共有四种不同化学环境氢原子的同分异构体的结构简式为__________、___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com