
����Ŀ����������Ҫ�Ļ���ԭ�ϡ�
(1)��֪�� N2(g)+O2(g)=2NO(g) ��H= +180.5kJ��mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H= -905kJ��mol-1
2H2(g)+O2(g)=2H2O(g) ��H= -483.6kJ��mol-1
д�������ڸ��¸�ѹ�������������ɵ������������Ȼ�ѧ����ʽ��_____________________�������1 L�ܱ������У�3mol NH3�ڵ��������³�ַ�Ӧ��2min��ﵽƽ�⣬ƽ��ʱ���յ�����Ϊ92.4 kJ ���������ʱ����v(H2)=___________________�������¶Ȳ��䣬����ʼNH3�����ʵ�������Ϊ8 mol��ƽ��ʱNH3��ת����Ϊ_________________��
(2)�����ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����д���÷�Ӧ�Ļ�ѧ����ʽ��___________________����ѧ�����ô�ԭ������Ƴɰ���һ����ȼ�ϵ�أ���ͨ�백���ĵ缫��_____________(��������������������)�����������£��õ缫������Ӧ�ĵ缫��ӦʽΪ______________________________________��
(3)һ�������£�ij�ܱ������з�����Ӧ��4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H<0����һ��������ܱ������У�Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ������д�ʩ�пɲ��õ���____________(����ĸ����)��
4NO(g)+6H2O(g) ��H<0����һ��������ܱ������У�Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ������д�ʩ�пɲ��õ���____________(����ĸ����)��
a������ѹǿ b���ʵ������¶� c������O2��Ũ�� d��ѡ���Ч����
(4)���ij��ˮ�ĵ���̶�Ϊ1%����Ũ��Ϊ0.01 mol/L MgCl2��Һ�еμӰ�ˮ����ʼ��������ʱ(������Һ����仯)��Һ�е�NH3��H2O��Ũ��Ϊ______________(��֪Ksp[Mg(OH)2]=4.010-12])��
���𰸡�2NH3(g)![]() N2(g)+ 3H2(g) ��H�� +92.4 kJ/ mol 1.5 mol��L-1��min-1 50% 4NH3+3O2 == 2N2+6H2O ���� 2NH3+6OH--6e- = N2+6H2O C 0.002 mol/L
N2(g)+ 3H2(g) ��H�� +92.4 kJ/ mol 1.5 mol��L-1��min-1 50% 4NH3+3O2 == 2N2+6H2O ���� 2NH3+6OH--6e- = N2+6H2O C 0.002 mol/L
��������
(1)��֪����N2(g)+O2(g)=2NO(g)��H=+180.5kJmol-1����4NH3(g)+5O2(g)=4NO(g)+6H2O(g)��H=-905kJmol-1����2H2(g)+O2(g)=2H2O(g)��H=-483.6kJmol-1�����ݸ�˹���ɣ�(��-����2-����3)��2�ɵã�2NH3(g)N2(g)+3H2(g)���ɴ˼�����H��
�����1L�ܱ������У�3mol NH3 �ڵ��������³�ַ�Ӧ��ƽ��ʱ�ķ�Ӧ��Ϊ92.4kJ��˵����Ӧ�İ���Ϊ2mol����
2NH3(g)N2(g)+3H2(g)
��ʼ��(mol)��3 0 0
�仯��(mol)��2 1 3
ƽ����(mol)��1 1 3
����v=![]() ����v(H2)��
����v(H2)��
�����¶Ȳ��䣬ƽ�ⳣ�����䣬����K=![]() ����ƽ�ⳣ��������ʼNH3�����ʵ�������Ϊ8mol����ת���İ������ʵ���Ϊxmol����ʾ��ƽ��ʱ��������ʵ������ٽ��ƽ�ⳣ���з��̼�����
����ƽ�ⳣ��������ʼNH3�����ʵ�������Ϊ8mol����ת���İ������ʵ���Ϊxmol����ʾ��ƽ��ʱ��������ʵ������ٽ��ƽ�ⳣ���з��̼�����
(2)�����ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ��Ӧ���ɵ�����ˮ������--����ȼ�ϵ�أ�ȼ���ڸ�������������Ӧ����ͨ�백���ĵ缫�Ǹ��������������£����ɵ�����ˮ��
(3)a������ѹǿ����Ӧ��������ƽ�������������С�ķ����ƶ���
b���ʵ������¶ȣ���Ӧ��������ƽ�������ȷ�Ӧ�ƶ���
c������Ӧ��������Ũ�ȣ�ƽ��������У���Ӧ��������
d��ѡ���Ч����ֻ�ܸı仯ѧ��Ӧ���ʣ�����Ӱ�컯ѧƽ�⣻
(4)��Һ��c(Mg2+)=0.01mol/L�������ܶȻ�����Ksp=c(Mg2+)��c2(OH-)=4.0��10-12 ������c(OH-)����ˮ��Ũ��=![]() ��
��
(1)��֪����N2(g)+O2(g)=2NO(g)��H=+180.5kJmol-1����4NH3(g)+5O2(g)=4NO(g)+6H2O(g)��H=-905kJmol-1����2H2(g)+O2(g)=2H2O(g)��H=-483.6kJmol-1�����ݸ�˹���ɣ�(��-����2-����3)��2�ɵã�2NH3(g)N2(g)+3H2(g)����H=+92.4 kJmol-1��
�����1L�ܱ������У�3mol NH3 �ڵ��������³�ַ�Ӧ��ƽ��ʱ�ķ�Ӧ��Ϊ92.4kJ��˵����Ӧ�İ���Ϊ2mol����
2NH3(g)N2(g)+3H2(g)
��ʼ��(mol)��3 0 0
�仯��(mol)��2 1 3
ƽ����(mol)��1 1 3
v(H2)=![]() =1.5mol/(Lmin)��
=1.5mol/(Lmin)��
ƽ�ⳣ��K=![]() =
=![]() =27�������¶Ȳ��䣬ƽ�ⳣ�����䣬����ʼNH3�����ʵ�������Ϊ8mol����ת���İ������ʵ���Ϊxmol����
=27�������¶Ȳ��䣬ƽ�ⳣ�����䣬����ʼNH3�����ʵ�������Ϊ8mol����ת���İ������ʵ���Ϊxmol����
2NH3(g)N2(g)+3H2(g)
��ʼ��(mol)��8 0 0
�仯��(mol)��x 0.5x 1.5x
ƽ����(mol)��8-x 0.5x 1.5x
��![]() =27�����x=4 ��ƽ��ʱ������ת����=
=27�����x=4 ��ƽ��ʱ������ת����=![]() ��100%=50%��
��100%=50%��
(2)�����ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ��Ӧ���ɵ�����ˮ����Ӧ�Ļ�ѧ����ʽ��4NH3+3O2 ![]() 2N2+6H2O������--����ȼ�ϵ�أ�ȼ���ڸ�������������Ӧ����ͨ�백���ĵ缫�Ǹ������������������ɵ�����ˮ���õ缫������Ӧ�ĵ缫��ӦʽΪ��2NH3+6OH--6e-=N2+6H2O��
2N2+6H2O������--����ȼ�ϵ�أ�ȼ���ڸ�������������Ӧ����ͨ�백���ĵ缫�Ǹ������������������ɵ�����ˮ���õ缫������Ӧ�ĵ缫��ӦʽΪ��2NH3+6OH--6e-=N2+6H2O��
(3)a����Ӧ�������������ķ�Ӧ������ѹǿ����Ӧ��������ƽ��������У���a�����ϣ�b����Ӧ�Ƿ��ȷ�Ӧ���ʵ������¶ȣ���Ӧ��������ƽ��������У���b�����ϣ�c������O2��Ũ�ȣ�ƽ��������У���Ӧ��������c���ϣ�d��ѡ���Ч����ֻ�ܸı仯ѧ��Ӧ���ʣ������ı仯ѧƽ�⣬��d�����ϣ��ʴ�Ϊc��
(4)���ij��ˮ�ĵ���̶�Ϊ1%��Ũ��Ϊ0.01mol/LMgCl2��Һ�μӰ�ˮ����ʼ��������ʱ(��������Һ����仯)��{��֪Ksp[Mg(OH)2]=4.0��10-12]}�������ݣ��ܶȻ�����Ksp=c(Mg2+)��c2(OH-)=4.0��10-12 ����Һ��c(Mg2+)=0.01mol/L����c(OH-)=2��10-5mol/L����ˮ��Ũ��=![]() =0.002mol/L��
=0.002mol/L��


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ָԪ�����ڱ��еڢ�A��Ԫ�أ����ǵĵ��ʺͻ�������;��Ϊ�㷺��
(1)��Ԫ�����γ�һ�ּ۸�ı�ʯ������ĸ�̣��仯ѧʽΪBe3Al2(SiO3)6��������Ԫ�صĻ��ϼ���________����̬��ԭ�ӵļ۵����Ų�ʽΪ________��
(2)þ�Ǻ��칤ҵ����Ҫ���ϡ�þԪ�غ�����Ԫ���ơ����ĵ�һ�����ܵĴ�С˳��Ϊ________��
(3)��Ԫ������Ȼ���Ի�����CaCl2��CaCO3��CaSO4��Ca(OH)2����ʽ���ڡ���������������ֻ����һ�����ͻ�ѧ������________��CO32-������ԭ�ӵ��ӻ�������________���ռ乹����________��

(4)��Ԫ������Ԫ���ܹ��γ�һ�ֻ�����侧���ṹ��ͼ��ʾ�������ʵĻ�ѧʽΪ________��Ba2+����λ����________���������ӵ�������ֵΪNA�������߳�Ϊa cm��������ܶ�Ϊ________g��cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�ʱ�����ݻ�Ϊ2L���ܱ������г���һ������SO2��O2��������Ӧ2SO2(g��+O2(g��![]() 2SO3(g�� H����196kJ��moL1��һ��ʱ����ƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
2SO3(g�� H����196kJ��moL1��һ��ʱ����ƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | n(SO2��/mol | n(O2��/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
����˵������ȷ����
A. ��Ӧ��ǰ5min��ƽ������Ϊv (SO2��=0.08mol��L1��min1
B. �����¶Ȳ��䣬��ƽ�����������ٳ���1molSO2��0.5molO2ʱ��v (������ v (�棩
C. ���¶ȣ���Ӧ��ƽ�ⳣ��Ϊ11.25L��mol��1
D. ��ͬ�¶��£���ʼʱ�������г���1.5mol SO3����ƽ��ʱSO3��ת����Ϊ40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����27.2gCu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡ����0.5L������������ȫ��Ӧ������NO��Cu(NO3)2����������Һ�м���1.0mol/L��NaOH��Һ1.0L����ʱ��Һ�����ԡ�������������ȫ��������������Ϊ39.2g�������й�˵������ȷ����
A. Cu��Cu2O�����ʵ���֮��Ϊ2��1 B. ��������ʵ���Ũ��Ϊ2.6mol/L
C. ������NO�ڱ�״���µ����Ϊ4.48L D. Cu��Cu2O�����ᷴӦ��ʣ��HNO3Ϊ0.2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����У��ڲ�ͬ�����£����ܷ���ˮ�ⷴӦ����ȥ��Ӧ�����ܷ���������Ӧ����������Ʒ�Ӧ�ų��������� (����)
��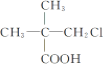 ��
��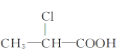 ��
��![]() ��
��
A. ��B. �ڢ�C. �٢�D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ��ˮ����Ҫ����Na+��K+��Mg2+��Cl-��SO42-��Br-��CO32-��HCO3-�����ӡ���������ʱȼú�ŷŵĺ�SO2�����������ú�ˮ�����乤��������ͼ��ʾ������˵��������ǣ�������

A.��Ȼ��ˮpH��8��ԭ�������ں�ˮ�е�CO32-��HCO3-ˮ��
B.��������������������H2SO3��HSO3-��SO32-����������SO42-
C.����Ӧ��ϡ����ʱ����Ȼ��ˮ��Ŀ�����к͡�ϡ�;�������ˮ�����ɵ���
D.���ŷ��������ĺ�ˮ��SO42-�����ʵ���Ũ�����������������Ȼ��ˮ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��HIO3��ǿ�ᣬ��ˮ��Һ��ǿ����������ҵ�ϣ���KIO3Ϊԭ�Ͽ��Ʊ�HIO3��ijѧϰС��������ͼװ���Ʊ����ᡣM��NΪ���Ե缫��ab��cdΪ����Ĥ�������ƶϴ�����ǣ� ��
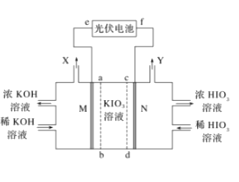
A.�����ص�e��Ϊ������M��������ԭ��Ӧ
B.�ڱ�״�����ռ�6720mLX��Y�Ļ������ʱKIO3��Һ����3.6g
C.Y���ĵ缫��ӦʽΪ2H2O-4e-�TO2��+4H+
D.�Ʊ�������Ҫ���Ƶ�ѹ����������HIO4������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ���������ȡ��ȩ(�е�Ϊ20.8�棬����ˮ����)��װ��(�г�װ������) ��ͼ��ʾ������˵���������

A.�����ý���������������ƽ����ѹ������Һ��˳������
B.ʵ�������ͭ˿����ֺ�ڽ���仯
C.ʵ�鿪ʼʱ���ȼ��Ȣڣ���ͨO2��Ȼ����Ȣ�
D.ʵ�����ʱ���Ƚ����еĵ����Ƴ�����ֹͣ���ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ӦN2(g)��3H2(g) ![]() 2NH3(g)�ﵽ��ѧƽ��״̬�ı�־��
2NH3(g)�ﵽ��ѧƽ��״̬�ı�־��
A. N2��H2��NH3�������������ٸı�
B. c(N2)��c(H2)��c(NH3)��1��3��2
C. ����1 mol N��N����ͬʱ���γ�6 mol N��H��
D. N2��H2�����ʵ���֮����NH3�����ʵ�����2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com