
【题目】I.迷迭香酸(F)的结构简式为: (该分子中的酚羟基有酸性,可与强碱中和);它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下:
(该分子中的酚羟基有酸性,可与强碱中和);它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下:

根据题意回答下列问题:
(1)迷迭香酸(F)的中无氧官能团为________________(填写名称)。写出结构简式:A________________;D________________。
(2)写出反应类型:反应①________________;反应②________________。
(3)反应③的试剂:________________________。
(4)1mol F与NaOH溶液反应,最多可消耗NaOH________mol。
(5)写出E与乙醇生成酯的化学反应方程式。___________________________________
II.乳酸![]() 有很强的防腐保鲜功效,可用在果酒、饮料、肉类等的保存,起到调节pH值、抑菌、延长保质期、调味、保持食品色泽、提高产品质量等作用。
有很强的防腐保鲜功效,可用在果酒、饮料、肉类等的保存,起到调节pH值、抑菌、延长保质期、调味、保持食品色泽、提高产品质量等作用。
(1)试写出以丙烯(CH2=CHCH3)为原料,合成乳酸的路线流程图(无机试剂任选)。(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)______________
目标产物)______________
【答案】碳碳双键 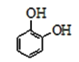
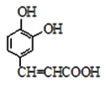 取代反应 消去反应 新制氢氧化铜悬浊液或银氨溶液、稀盐酸(或稀硫酸) 6
取代反应 消去反应 新制氢氧化铜悬浊液或银氨溶液、稀盐酸(或稀硫酸) 6  +CH3CH2OH
+CH3CH2OH  H2O+
H2O+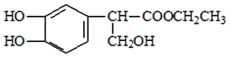
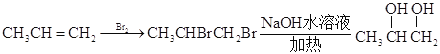
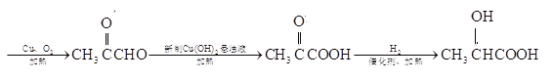
【解析】
由D的分子式和F的结构简式可确定D为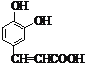 ,E为
,E为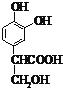 ,则C为
,则C为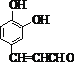 ,由A的分子式结合D的结构可知A为
,由A的分子式结合D的结构可知A为![]() ,发生取代反应生成B为
,发生取代反应生成B为 ,结合有机物的结构和性质以及题目要求可解答该题。
,结合有机物的结构和性质以及题目要求可解答该题。
I.(1)迷迭香酸(F)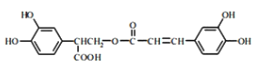 的中无氧官能团为碳碳双键。由分析,结构简式:A为
的中无氧官能团为碳碳双键。由分析,结构简式:A为![]() ;D为
;D为 。
。
(2)反应类型:A为![]() ,与溴发生取代反应生成B,C为
,与溴发生取代反应生成B,C为 ,对比反应物和生成物的结构可知应为消去反应。
,对比反应物和生成物的结构可知应为消去反应。
(3)C为 ,在新制氢氧化铜或银氨溶液作用下发生氧化反应,然后用稀盐酸或稀硫酸反应可生成D。
,在新制氢氧化铜或银氨溶液作用下发生氧化反应,然后用稀盐酸或稀硫酸反应可生成D。
(4)F 对应的水解产物中共含有4个酚羟基和2个羧基,则消耗6molNaOH;
对应的水解产物中共含有4个酚羟基和2个羧基,则消耗6molNaOH;
(5)写出E 中含有羧基与乙醇生成酯和水,化学反应方程式
中含有羧基与乙醇生成酯和水,化学反应方程式  +CH3CH2OH
+CH3CH2OH  H2O+
H2O+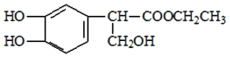
II.![]() 与溴加成,水解后引入两个羟基,得
与溴加成,水解后引入两个羟基,得![]() ,在铜作催化剂,加热条件下氧化成
,在铜作催化剂,加热条件下氧化成![]() ,再将醛基氧化成羧基,最后将羰基还原成羟基:
,再将醛基氧化成羧基,最后将羰基还原成羟基: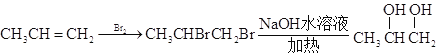
 。
。


科目:高中化学 来源: 题型:
【题目】下列各组物质:(用序号填空)
① O2和O3 ; ②12C 与14C; ③ CH3 (CH2) 3 CH3和![]()
④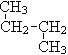 和
和![]() ;
;
(1)互为同位素的是_______ ;(2)互为同素异形体的是________;
(3)互为同分异构体的是________;(4)属于同一物质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在空气中泄漏的二氧化硫,会被氧化而形成硫酸雾或硫酸盐气溶胶,污染环境。工业上常用Na2SO3溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
(1)写出用Na2SO3溶液吸收SO2的离子方程式。________________
(2)钠原子核外有________种能量不同的电子。写出硫原子最外层电子的轨道表示式。____________
(3)H2O比H2S稳定,请用分子结构的知识简述其理由。______________________
II.一定温度下,固定容积的密闭容器中反生下列反应:2C(s)+2SO2(g) ![]() S2(g)+2CO2(g),反应过程中,各物质浓度与时间的关系如图:
S2(g)+2CO2(g),反应过程中,各物质浓度与时间的关系如图:
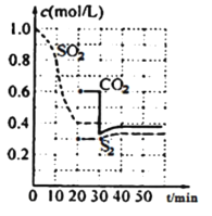
(4)该反应平衡常数表达式为K=________
(5)0~20min化学反应速率表示v(SO2)=________;建立平衡过程中,混合气体的密度________(选填“增大”、“减小”或“不变”)简述其原因。___________________________
(6)30min时改变外界条件,使v(正)________v(逆)(选填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业烧碱中常含氯化钠等杂质。
(1)简述检验工业烧碱中含有氯化钠的实验方法___;
(2)写出一种工业烧碱中还可能含有的杂质的化学式___;
(3)某同学采用硝酸银将离子沉淀的方法测定工业烧碱的纯度,取ag样品,经一系列操作,分离并称得氯化银的质量mg,则氢氧化钠纯度计算式为__。已知该测定结果偏低,可能的原因是__;
A.未将氢氧化钠去除 B.氯化银颗粒细小,难以过滤
C.氯化银部分分解 D.氯化银沉淀未洗涤干燥
(4)粗盐提纯过程中,除去硫酸根离子可选用的试剂是__;
A.氯化钡 B.氢氧化钡 C.硝酸钡 D.盐酸
(5)氯化钾的熔点低于氯化钠,从物质结构的角度加以解释___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,发生反应:2A(g)+B(s)![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A
⑥单位时间内生成n molC,同时消耗n mol D
A. ①②③ B. ③④⑥ C. ②③⑤⑥ D. 只有 ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
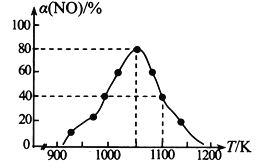
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
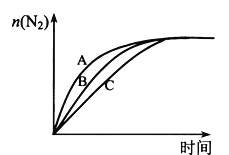
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com