
【题目】工业烧碱中常含氯化钠等杂质。
(1)简述检验工业烧碱中含有氯化钠的实验方法___;
(2)写出一种工业烧碱中还可能含有的杂质的化学式___;
(3)某同学采用硝酸银将离子沉淀的方法测定工业烧碱的纯度,取ag样品,经一系列操作,分离并称得氯化银的质量mg,则氢氧化钠纯度计算式为__。已知该测定结果偏低,可能的原因是__;
A.未将氢氧化钠去除 B.氯化银颗粒细小,难以过滤
C.氯化银部分分解 D.氯化银沉淀未洗涤干燥
(4)粗盐提纯过程中,除去硫酸根离子可选用的试剂是__;
A.氯化钡 B.氢氧化钡 C.硝酸钡 D.盐酸
(5)氯化钾的熔点低于氯化钠,从物质结构的角度加以解释___。
【答案】取样,加水溶解,加入稀硝酸酸化,再滴入硝酸银溶液,若有白色沉淀生成说明含有氯化钠 NaClO 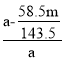 AD AB K+半径大于Na+,因此氯化钾晶体中离子键弱于氯化钠,熔点较低
AD AB K+半径大于Na+,因此氯化钾晶体中离子键弱于氯化钠,熔点较低
【解析】
(1)![]() 的检验用硝酸银,但是要先加足量硝酸中和氢氧化钠,现象是产生白色沉淀;
的检验用硝酸银,但是要先加足量硝酸中和氢氧化钠,现象是产生白色沉淀;
(2)工业制取烧碱: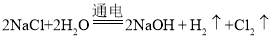 ,氯气有可能和氢氧化钠反应产生次氯酸钠杂质;
,氯气有可能和氢氧化钠反应产生次氯酸钠杂质;
(3)氢氧化钠的纯度为总质量减去杂质氯化钠的总质量然后除以总质量;若测得沉淀质量偏大,则计算所得杂质氯化钠质量偏大,纯度偏小;
(4)除杂时要除掉杂质但是不能引入新杂质;
(5)氯化钾的熔点低于氯化钠是因为![]() 半径大于
半径大于![]() ,因此氯化钾晶体中离子键弱于氯化钠,熔点较低。
,因此氯化钾晶体中离子键弱于氯化钠,熔点较低。
(1)![]() 的检验用硝酸银,但是要先加足量硝酸中和氢氧化钠,现象是产生白色沉淀;
的检验用硝酸银,但是要先加足量硝酸中和氢氧化钠,现象是产生白色沉淀;
故答案为:取样,加水溶解,加入稀硝酸酸化,再滴入硝酸银溶液,若有白色沉淀生成说明含有氯化钠;
(2)工业制取烧碱: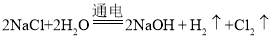 ,产生的氯气有可能和氢氧化钠反应产生次氯酸钠杂质;
,产生的氯气有可能和氢氧化钠反应产生次氯酸钠杂质;
故答案为:![]() ;
;
(3)![]() 的物质的量为:
的物质的量为:![]() ,即杂质氯化钠的物质的量也是
,即杂质氯化钠的物质的量也是![]() ,氯化钠的质量为
,氯化钠的质量为![]() ,氢氧化钠的纯度为总质量减去杂质氯化钠的总质量然后除以总质量,即
,氢氧化钠的纯度为总质量减去杂质氯化钠的总质量然后除以总质量,即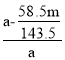 ;
;
A.未除去氢氧化钠,造成生成沉淀质量偏大,计算所得杂质氯化钠质量偏大,纯度偏小,A正确;
B.氯化银颗粒细小,难以过滤,会造成沉淀质量偏小,计算所得杂质氯化钠质量偏小,纯度偏大,B错误;
C.氯化银部分分解为银和氯气,沉淀质量减小,计算所得杂质氯化钠质量减小,纯度偏大,C错误;
D.氯化银沉淀未洗涤干燥,造成沉淀质量偏大, 计算所得杂质氯化钠质量偏大,纯度偏小,D正确;
故答案为: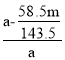 ;AD;
;AD;
(4)除杂时要除掉杂质但是不能引入新杂质,
A.加入氯化钡不会引入新杂质,能够除去硫酸根离子,A正确;
B.加入氢氧化钡会引入氢氧根,但是后续操作还会加入盐酸调节pH,中和氢氧化根离子,B正确;
C.加入硝酸钡可以除掉硫酸根,但是会引入硝酸根杂质,且后续无法出去,C错误;
D.加入盐酸无法除掉硫酸根,D错误;
故答案选:AB;
(5)氯化钾的熔点低于氯化钠是因为![]() 半径大于
半径大于![]() ,因此氯化钾晶体中离子键弱于氯化钠,熔点较低;
,因此氯化钾晶体中离子键弱于氯化钠,熔点较低;
故答案为:![]() 半径大于
半径大于![]() ,因此氯化钾晶体中离子键弱于氯化钠,熔点较低。
,因此氯化钾晶体中离子键弱于氯化钠,熔点较低。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】按要求填空
Ⅰ(1)萘的结构式为![]() ,它的二氯代物有______种。
,它的二氯代物有______种。
(2)立方烷![]() 的六氯代物有______种。
的六氯代物有______种。
Ⅱ根据下列有机化合物的官能团,写出下列反应的方程式。

(1)A 发生银镜反应___________________________________________________________
(2) B与足量的碳酸钠溶液反应_____________________________________
(3)C在足量的氢氧化钠水溶液中反应__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ
2HI(g)+9.48kJ
(ii)I2(s)+H2(g)=2HI(g)-26.48kJ
下列判断正确的是
A.254gI2(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定
D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.迷迭香酸(F)的结构简式为: (该分子中的酚羟基有酸性,可与强碱中和);它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下:
(该分子中的酚羟基有酸性,可与强碱中和);它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下:

根据题意回答下列问题:
(1)迷迭香酸(F)的中无氧官能团为________________(填写名称)。写出结构简式:A________________;D________________。
(2)写出反应类型:反应①________________;反应②________________。
(3)反应③的试剂:________________________。
(4)1mol F与NaOH溶液反应,最多可消耗NaOH________mol。
(5)写出E与乙醇生成酯的化学反应方程式。___________________________________
II.乳酸![]() 有很强的防腐保鲜功效,可用在果酒、饮料、肉类等的保存,起到调节pH值、抑菌、延长保质期、调味、保持食品色泽、提高产品质量等作用。
有很强的防腐保鲜功效,可用在果酒、饮料、肉类等的保存,起到调节pH值、抑菌、延长保质期、调味、保持食品色泽、提高产品质量等作用。
(1)试写出以丙烯(CH2=CHCH3)为原料,合成乳酸的路线流程图(无机试剂任选)。(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)______________
目标产物)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买同的硫酸试剂标签上的部分内容。据此下列说法正确的是
硫酸化学纯(CP)
(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84g / cm3
质量分数:98%
A.该硫酸的物质的量浓度为1.84mol/L
B.1mol Zn与足量的该硫酸反应产生2gH2
C.配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D.该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A. 3g 3He含有的中子数为1NA
B. 1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应:A2(g)+B2(g)![]() 2AB(g),达到平衡的标志是( )
2AB(g),达到平衡的标志是( )
A.容器的总压强不随时间而变化
B.单位时间内生成nmolA2同时就有2nmolAB生成
C.单位时间内有nmolB2发生反应的同时有nmolAB分解
D.单位时间内有nmolA2生成的同时有nmolB2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国Lawrece Liermore国家实验室(LINL)成功地在高压下将![]() 转化为具有类似
转化为具有类似![]() 结构的原子晶体,下列关于
结构的原子晶体,下列关于![]() 的原子晶体说法,正确的是:
的原子晶体说法,正确的是:
A. ![]() 的原子晶体和分子晶体互为同分异构体
的原子晶体和分子晶体互为同分异构体
B. 在一定条件下,![]() 原子晶体转化为
原子晶体转化为![]() 分子晶体是物理变化
分子晶体是物理变化
C. ![]() 的原子晶体和
的原子晶体和![]() 分子晶体具有相同的物理性质和化学性质
分子晶体具有相同的物理性质和化学性质
D. 在![]() 的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com