
【题目】在一定温度下,可逆反应:A2(g)+B2(g)![]() 2AB(g),达到平衡的标志是( )
2AB(g),达到平衡的标志是( )
A.容器的总压强不随时间而变化
B.单位时间内生成nmolA2同时就有2nmolAB生成
C.单位时间内有nmolB2发生反应的同时有nmolAB分解
D.单位时间内有nmolA2生成的同时有nmolB2生成
【答案】B
【解析】
可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变。
A.该反应前后气体总物质的量不变,则无论该反应是否达到平衡状态,压强始终不变,所以不能根据压强判断平衡状态,故A错误;
B.单位时间内生成n mol A2的同时生成2n molAB,则同时消耗n mol A2,A2的正逆反应速率相等,则该反应达到平衡状态,故B正确;
C.单位时间内有nmolB2发生反应,同时有nmolAB分解即有0.5nmolB2生成,B2的正逆反应速率不相等,故C错误;
D. 单位时间内有nmolA2生成,同时有nmolB2生成,均表示逆速率,无法判断正逆速率是否相同,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业烧碱中常含氯化钠等杂质。
(1)简述检验工业烧碱中含有氯化钠的实验方法___;
(2)写出一种工业烧碱中还可能含有的杂质的化学式___;
(3)某同学采用硝酸银将离子沉淀的方法测定工业烧碱的纯度,取ag样品,经一系列操作,分离并称得氯化银的质量mg,则氢氧化钠纯度计算式为__。已知该测定结果偏低,可能的原因是__;
A.未将氢氧化钠去除 B.氯化银颗粒细小,难以过滤
C.氯化银部分分解 D.氯化银沉淀未洗涤干燥
(4)粗盐提纯过程中,除去硫酸根离子可选用的试剂是__;
A.氯化钡 B.氢氧化钡 C.硝酸钡 D.盐酸
(5)氯化钾的熔点低于氯化钠,从物质结构的角度加以解释___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,发生反应:2A(g)+B(s)![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A
⑥单位时间内生成n molC,同时消耗n mol D
A. ①②③ B. ③④⑥ C. ②③⑤⑥ D. 只有 ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18g/ml,质量分数为36.5%浓盐酸配制250ml0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250ml0.1mol/L的盐酸溶液.应量取盐酸体积_________ml,应选用容量瓶的规格__________________ml。
(2)配制时,其正确的操作顺序是________。
A.用30ml水洗涤烧杯 2﹣3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.将容量瓶盖紧、振荡、摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处
a.BCAFED b.BCFED c.BCAED
(3)操作B中,使用量筒量取液体时视线俯视会造成配制液体浓度__________(偏高、偏低或无影响)。操作E中加水超过刻度线该如何处理?____________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作____________;
b.加蒸馏水时不慎超过了刻度___________;
c.定容时俯视_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的科学家获得了极具理论研究意义的N4分子,N4分子结构如图所示。下列有关N4的说法正确的是( )
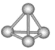
A. N4的沸点比N2低
B. N4分子中只含有非极性键,且键的夹角为109°28′
C. N4分子中每个氮原子都满足8个电子
D. 1mol N4中含有9 mol共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“张亭栋研究小组”受民间中医启发,发现As2O3对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)为第VA族元素,该族元素的化合物在研究和生产中有着许多重要用途。
(1)N原子的价电子排布式为___,N、P、As原子的第一电离能由大到小的顺序为___。
(2)NH3的沸点比AsH3的沸点高,原因是_____。
(3)立方氮化硼晶体(BN),是一种超硬材料,有优异的耐磨性,其晶胞如图所示。
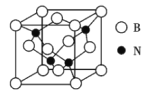
立方氮化硼是____晶体,晶体中N原子的杂化轨道类型为___,B原子的配位数为______。
(4)若立方氮化硼晶胞的边长为362 pm,则立方氮化硼的密度为____g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
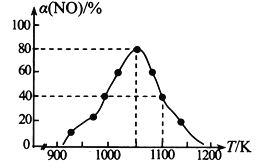
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
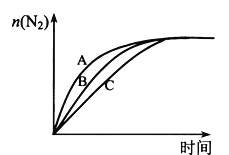
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在化合物中通常是Fe(Ⅱ)、Fe(Ⅲ),现有一定量固体物质A,可能由FeSO4、Fe2(SO4)3组成,通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设:该固体物质是FeSO4;或该固体物质是Fe2(SO4)3;或该固体物质是___。
(2)设计实验方案:取少量固体物质A于烧杯中,加适量水溶解A,然后取两份A溶液分别进行实验,实验现象与结论如表:
实验方法 | 实验现象 | 结论 |
在溶液中加入KSCN溶液 | ___ | 固体物质中有Fe2(SO4)3 |
在酸性KMnO4溶液中加入少量A振荡 | KMnO4溶液颜色无明显变化 | 固体物质中不含___。 |
(3)若该固体A可能还存在铁,则不能证明固体物质中含___,其理由至少有两个,请分别用离子方程式表示___、___。
(4)![]() ,写出由“白色沉淀”转化为“红褐色沉淀”的化学方程式___。
,写出由“白色沉淀”转化为“红褐色沉淀”的化学方程式___。
(5)上述白色沉淀在空气中迅速变成灰绿色,最后变成红褐色,由此得出Fe(Ⅱ)的还原性强弱与___有关,FeSO4的还原性___Fe(OH)2(填“大于”“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com