
【题目】某化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置:
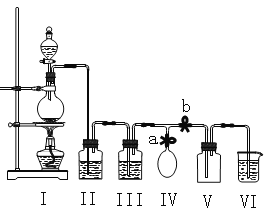
(1)写出Ⅰ装置烧瓶中发生的反应的离子方式: 。
(2)装置Ⅱ中盛放的药品是饱和氯化钠溶液,其作用是 ;装置Ⅲ的作用是干燥氯气,应盛放___________。
(3)实验开始后,先 a b(填“关闭”或“打开”,下同);当集满一瓶氯气时,为减少换集气瓶时氯气的外溢,再 a b,换好集气瓶后,继续收集氯气
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中不恰当的是(填序号) 。
A.氢氧化钠溶液 B.浓硫酸 C.水
(5)氯气是重要的化工原料,以乙烯、氯气、氢氧化钙和水等物质为原料制取环氧乙烷(C2H4O),教材中介绍经典的方法包括两部反应:
①CH2=CH2+Cl2+H2O→ClCH2CH2OH+HCl
②ClCH2CH2OH+HCl+Ca(OH)2→C2H4O+CaCl2+2H2O
根据以上两步,求生成环氧乙烷的原子利用率为 %。
【答案】
(1)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)除去Cl2中混有的HCl、浓硫酸;
(3)关闭、打开、打开、关闭;
(4)BC;(5)25.4;
【解析】
试题分析:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气,离子方程式为:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)浓盐酸制取的氯气中含有氯化氢气体和水蒸气,为防止干扰实验,氯气在进入烧瓶前,应该用饱和食盐水和浓硫酸分别除去氯化氢和水蒸气;故答案为:除去Cl2中混有的HCl、浓硫酸;
(3)实验开始后,先收集氯气,则关闭a,打开b;当集满一瓶氯气时,为减少换集气瓶时氯气的外溢,多余的氯气用气囊来收集,则打开a,关闭b;故答案为:关闭、打开、打开、关闭;
(4)氯气能够与氢氧化钠溶液,在水中的溶解度不大,且溶解得氯气部分与水反应,氯气与稀硫酸不反应,所以其中不恰当的是浓硫酸和水;故选:BC;
(5)将①+②得CH2 = CH2+ Cl2+Ca(OH)2→G2H4O+ CaCl2+H2O,生成环氧乙烷的原子利用率为![]() ×100%=
×100%=![]() ×100%=25.4%,故答案为:25.4。
×100%=25.4%,故答案为:25.4。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A.向Al2(SO4)3溶液中加入过量NH3·H2O:Al3++4NH3·H2O===[Al(OH)4]-+4NH![]()
B. 铅酸蓄电池充电时的正极反应:PbO2+4H++SO![]() +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
C.Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-===Fe(OH)3 ↓ + BaSO4↓
D.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-===Fe(OH)2↓+2NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O
电解池:2Al+3H2O![]() Al2O3+3H2↑ 电解过程中,以下判断正确的是
Al2O3+3H2↑ 电解过程中,以下判断正确的是
电池 | 电解池 | |
A. | H+移向Pb电极 | H+移向Pb电极 |
B. | 每消耗3 mol Pb | 生成2 mol Al2O3 |
C. | 正极:PbO2+4H++2e-===Pb2++2H2O | 阳极:2Al+3H2O-6e-===Al2O3+6H+ |
D. |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
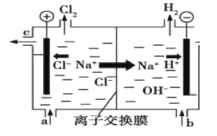
(1)写出电解饱和食盐水的离子方程式 。
(2)离子交换膜的作用为 : 、 。
(3)精制饱和食盐水从图中__________位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
(5)室温下,0.1mol/LNaClO溶液的pH 0.1 mol/LNa2SO3溶液的pH。(选填“大于”、“小于”或“等于”)
(6)浓度均为0.1mol/L的N2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为 。
(7)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
①联氨分子的电子式为 。
②实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Y1L的H2和Y2L的N2在一定条件下发生反应,达到平衡后,混合气体总体积为Y3L(气体体积均在相同条件下测定),则生成NH3的体积是
A.(Y1+Y2-Y3)L B.(Y1+Y2+Y3)L C.(Y1+ Y2-2Y3)L D.[Y3-(Y1+Y2)]L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.反应AlCl3+4NaOH===NaAlO2+3NaCl+2H2O,可以设计成原电池
B.Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率
C.把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化
D.Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关活化分子和活化能的说法不正确的是
A.增加气体反应物的浓度可以提高活化分子百分数
B.升高温度可增加单位体积活化分子数
C.发生有效碰撞的分子一定是活化分子
D.使用催化剂可降低活化能,提高活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分类法是交叉分类法的是( )
A.氧化物可分为金属氧化物和非金属氧化物
B.S2-、I-、NH4+、SO42-按某种属性可分为两类
C.氢氧化钙既是纯净物又是化合物,属于碱
D.物质的分离方法可分为蒸馏、分液、蒸发、萃取、过滤等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com