
B.0.03 mol·L-1的醋酸与0.01 mol·L-1的NaOH溶液等体积的混合液
C.0.01 mol·L-1的醋酸溶液
D.pH=2的盐酸与pH=12的NaOH溶液等体积的混合液
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:阅读理解
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
 ,下列说法正确的是
,下列说法正确的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
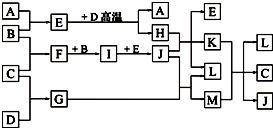 如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).
如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).查看答案和解析>>
科目:高中化学 来源: 题型:

回答下列问题:
(1)化合物E、M的沸点____________高(填化学式),原因是_______________________。
(2)甲、乙两种元素还可以形成一种含有4个原子核和18个电子的化合物,该化合物的结构式为_________________________________。
(3)E与D高温反应的化学方程式为________________________,K与M在水溶液中反应的离子方程式为____________________________________________。
(4)实验室在保存L溶液时,需加入少量D,理由是________________________,实验室检验L的水溶液中的阳离子的方法是________________________________________。
(5)已知一定条件下每1 mol F与单质B完全反应生成I放热98.0 kJ,若2 mol F与1 mol B在此条件下发生反应,达平衡时,放出热量为176.4 kJ,则F的转化率为____________,平衡时F的物质的量为____________,若保持温度和压强不变(反应混合物都为气体)按下列四种配比作为起始物质充入,达到平衡时各物质的物质的量与上述平衡状态相同的是_______________。
A.4 mol F 2 mol B
B.2 mol F 1 mol B 2 mol I
C.1 mol F 0.5 mol B 1 mol I
D.3 mol I 1 mol Ne
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省商丘市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
|
化学式 |
HF |
H2CO3 |
HClO |
|
电离平衡常数 (K) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(2)25℃时,在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。

A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-bkJ·mol—1,
氢氟酸的电离方程式及热效应可表示为________________________。
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与等物质的量的H2O反应得到HF和化合物A,则每生成1molHF转移_______mol电子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1
(1)试写出常温常压下化学平衡常数K的表达式:K=_________________;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是_____(选填编号)。
a.降低温度 b.移走SO2Cl2
c.增加反应物浓度 d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是____________(选填编号)。
a.υ(Cl 2)=υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl 2) : c(SO2)=1:1 d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g。若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com