
【题目】芳香烃X,相对分子质量为92。以X为初始原料合成E,路线如下(部分产物和反应条件已略去)。

回答下列问题:
(1)有机物X的结构简式为_________________。
(2)A→B的反应条件为________________________________。
(3)C→D转化中①的化学方程式为________________________________。
(4)下列关于B的说法正确的是____________。
a.核磁共振氢谱有5个峰 b.能发生消去反应和还原反应
c.能与钠反应放出氢气 d.能和NaOH溶液反应
(5)E有多种同分异构体,同时符合下列条件的同分异构体共有_______种。
①遇NaHCO3溶液有气体放出 ②芳香族化合物
其中不含甲基的有机物的结构简式为_________。
(6)有机物X可通过三步合成W,W是高分子化合物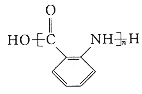 的单体。
的单体。
已知:Ⅰ.苯环上的甲基可以被酸性KMnO4氧化成羧基
Ⅱ.苯环侧链的硝基可被Fe/HCl还原为氨基,苯环侧链的氨基易被氧化
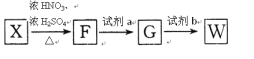
①F的结构简式为_______________,试剂a为_______________。
②在一定条件下W聚合成高分子化合物的化学方程式为___________________________。
【答案】![]() NaOH水溶液、加热C6H5-CHO + 2Ag(NH3)2OH→H2O+2Ag+3NH3+ C6H5-COONH4 (条件:水浴加热)ac14种
NaOH水溶液、加热C6H5-CHO + 2Ag(NH3)2OH→H2O+2Ag+3NH3+ C6H5-COONH4 (条件:水浴加热)ac14种![]()
 酸性KMnO4
酸性KMnO4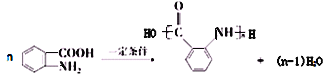
【解析】
相对分子质量为92的某芳香烃X,令分子组成为CxHy,则![]() ,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,其结构简式为
,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,其结构简式为![]() ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为![]() ,B为
,B为![]() ,C为
,C为![]() ,D为
,D为![]() ,苯甲酸与乙醇发生酯化反应生成E为
,苯甲酸与乙醇发生酯化反应生成E为![]() 。
。
(1)有机物X的结构简式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)A→B发生卤代烃水解反应,反应条件为:NaOH水溶液、加热,故答案为:NaOH水溶液、加热;
(3)C→D转化中①是![]() 与银氨溶液发生氧化反应生成
与银氨溶液发生氧化反应生成![]() ,反应方程式为:C6H5-CHO + 2Ag(NH3)2OH→H2O+2Ag+3NH3+ C6H5-COONH4 (条件:水浴加热),故答案为:C6H5-CHO + 2Ag(NH3)2OH→H2O+2Ag+3NH3+ C6H5-COONH4 (条件:水浴加热)。
,反应方程式为:C6H5-CHO + 2Ag(NH3)2OH→H2O+2Ag+3NH3+ C6H5-COONH4 (条件:水浴加热),故答案为:C6H5-CHO + 2Ag(NH3)2OH→H2O+2Ag+3NH3+ C6H5-COONH4 (条件:水浴加热)。
(4)下列关于B(![]() )的说法:
)的说法:
a.分子中含有5种H原子,核磁共振氢谱有5个峰,故a正确;
b.能与氢气发生加成反应,属于还原反应,不能发生消去反应,故b错误;
c.含有醇羟基,能与钠反应放出氢气,故c正确;
d.醇羟基不能和NaOH溶液反应,故d错误,
故选:ac;
(5)E(![]() )的同分异构体同时符合下列条件:
)的同分异构体同时符合下列条件:
①遇NaHCO3溶液有气体放出,说明含有羧基,②芳香族化合物,说明含有苯环,含有一个取代基为-CH2CH2COOH或者-CH(CH3)COOH,含有2个取代基为-CH3、-CH2COOH,或者-CH2CH3、-COOH,各有邻、间、对3种,含有3个取代基为2个-CH3、-COOH,2个-CH3处于邻位,-COOH有2种位置,2个-CH3处于间位,-COOH有3种位置,2个-CH3处于对位,-COOH有1种位置,共有14种,其中不含甲基的有机物的结构简式为![]() ,
,
故答案为:14;![]() ;
;
(6)由高分子化合物的结构简式,逆推可知W为![]() ,
,![]() 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为![]() ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为![]() ,G与Fe/HCl反应生成W.
,G与Fe/HCl反应生成W.
①F的结构简式为:![]() ,试剂a为:酸性KMnO4溶液,故答案为:
,试剂a为:酸性KMnO4溶液,故答案为:![]() ;酸性KMnO4溶液;
;酸性KMnO4溶液;
②在一定条件下W聚合成高分子化合物的化学方程式为: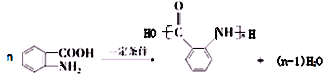
故答案为:


科目:高中化学 来源: 题型:
【题目】一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法不正确的是
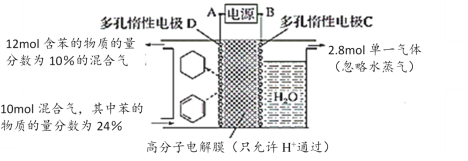
A. 电源A为负极,电极C为阳极
B. 单一气体为O2
C. 该储氢装置的电流效率约为32.1%(电流效率计算公式为=![]() ×100%)
×100%)
D. 电子流动方向为:A→D;C→B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有 K+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验:(所加试剂均过量,气体全部逸出)下列说法不正确的是

A. 原溶液中一定存在SO42–、CO32–和NH4+
B. 原溶液中一定不存在Ca2+,无法判断Cl–是否存在
C. 要确定Cl–是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D. 原溶液中 c(K+ )≥0.1 mol· Lˉ 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水、易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:

完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸500 mL,所需的玻璃仪器有玻璃棒、________________________。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是__________,控制溶液的pH约为8.0的目的是________________________。
(3)试剂b是__________,步骤Ⅳ的目的是________________________________。
(4)步骤Ⅴ所含的操作依次是____________________。
(5)制得的溴化钙可以通过如下步骤测定其纯度:①称取4.00 g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④__________;⑤称量。若得到1.88 g碳酸钙,则溴化钙的质量分数为__________(保留两位有效数字)。若实验操作规范而测定结果偏低,其原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。N在元素周期表中的位置:____________。元素C、N最简单气态氢化物中稳定性更强的是_______(填化学式)。
氨气应用于侯德榜制碱工艺,原理如下图所示:

(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分为Al2O3和SiO2(含有少量不溶性杂质),利用铝土矿制备Al(OH)3流程如下(所用化学试剂均过量)。
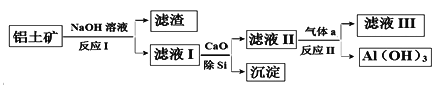
下列说法不正确的是
A. Al(OH)3可用作治疗胃酸过多
B. 加CaO除Si得到的沉淀主要成分为H2SiO3
C. 气体a成分为CO2
D. 滤液III中溶质为Ca(HCO3)2和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
![]()
(1)若 A 是一种金属,C 是淡黄色固体,C 的阴阳离子个数比为_______;
(2)若 A 为淡黄色固体单质,写出 D 的浓溶液与铜反应的化学方程式_______;
(3)若 A 是化合物,C 是红棕色气体,则 A 的化学式为_____;C 转化为 D 的过程中,氧化剂与还原剂的质量比为_____。
(4)若 A 为黑色固体单质,C 是空气中的主要温室气体。C 还可以转化为 A,写出该反应的化学方程 式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置也可用于检验溴乙烷与氢氧化钠的醇溶液反应生成物乙烯的检验,下列说法不正确的是
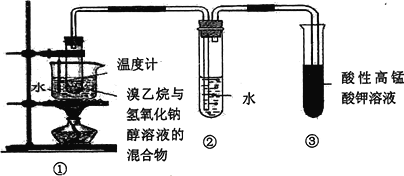
A. 该反应为消去反应 B. 反应实验过程中可观察到酸性KMnO4溶液褪色
C. 可用溴水溶液代替酸性KMnO4溶液 D. 乙烯难溶于水,故此装置②可以省去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com