
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水、易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:

完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸500 mL,所需的玻璃仪器有玻璃棒、________________________。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是__________,控制溶液的pH约为8.0的目的是________________________。
(3)试剂b是__________,步骤Ⅳ的目的是________________________________。
(4)步骤Ⅴ所含的操作依次是____________________。
(5)制得的溴化钙可以通过如下步骤测定其纯度:①称取4.00 g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④__________;⑤称量。若得到1.88 g碳酸钙,则溴化钙的质量分数为__________(保留两位有效数字)。若实验操作规范而测定结果偏低,其原因是_______________________________________。
【答案】烧杯、量筒 石灰水除去Al3+、Fe3+提高产品的纯度和产率氢溴酸除去过量的石灰水浓缩结晶 过滤洗涤、干燥94%溴化钙已潮解
【解析】
(1)用浓溶液配制500mL稀溶液,因此需要量筒取经过计算需要的浓溶液的体积,然后在烧杯中溶解、配制500mL溶液;(2)加入的试剂a、控制溶液的pH约为8.0的目的是除去杂质Al3+、Fe3+,防止氢氧化铝溶解,因此a是碱,根据题意及不引入新的杂质可知是氢氧化钙;(3)加试剂b的目的是除去过量的a,是氢溴酸;(4)步骤Ⅴ的结果得到CaBr2·6H2O,因此其操作步骤为蒸发浓缩,冷却结晶、过滤;(5)④对滤渣洗涤,除去表面吸附的离子,然后烘干、冷却;根据CaBr2~CaCO3可求CaBr2的质量为,进而计算质量分数;溴化钙已潮解,因此造成测定结果偏低。
(1)用浓溶液配制500mL稀溶液,因此需要量筒取经过计算需要的浓溶液的体积,然后在烧杯中溶解、配制500mL溶液,故答案为:量筒、烧杯;(2)加入的试剂a、控制溶液的pH约为8.0的目的是除去杂质Al3+、Fe3+,防止氢氧化铝溶解,因此a是碱,根据题意及不引入新的杂质可知是氢氧化钙;(3)加试剂b的目的是除去过量的氢氧化钙,且不引入新杂质,故b应是氢溴酸;(4)步骤Ⅴ的结果从溶液中得到CaBr2·6H2O,因此其操作步骤为蒸发浓缩,冷却结晶、过滤;(5)④对滤渣洗涤,除去表面吸附的离子,然后烘干、冷却;
CaBr2~CaCO3
200 100
3.76g 1.88g
故CaBr2的质量为3.76g,质量分数为=![]() =94%;溴化钙已潮解,因此造成测定结果偏低。
=94%;溴化钙已潮解,因此造成测定结果偏低。


科目:高中化学 来源: 题型:
【题目】青海昆仑玉被定为2008年北京奥运会奖牌用玉,昆仑玉主要成分是由"透闪石"和"阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2Mg5Si8O22(OH)2透闪石的化学式写成氧化物的形式为:________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有Mg2+、Al3+、Fe3+、Cu2+、NH4+、Na+中的一种或几种,取100mL该溶液,向其中不断滴加NaOH溶液,产生的沉淀随着NaOH体积变化的关系如图所示,则下列叙述不正确的是
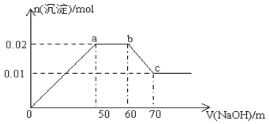
A. 该溶液中一定不含Fe3+、Cu2+
B. 该溶液中一定含有Mg2+、Al3+、NH4+,且三者物质的量浓度之比为1∶1∶1
C. 所加NaOH溶液物质的量浓度为0.1mol/L
D. a点到b点,发生的化学反应:NH4++ OH—=NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃X,相对分子质量为92。以X为初始原料合成E,路线如下(部分产物和反应条件已略去)。

回答下列问题:
(1)有机物X的结构简式为_________________。
(2)A→B的反应条件为________________________________。
(3)C→D转化中①的化学方程式为________________________________。
(4)下列关于B的说法正确的是____________。
a.核磁共振氢谱有5个峰 b.能发生消去反应和还原反应
c.能与钠反应放出氢气 d.能和NaOH溶液反应
(5)E有多种同分异构体,同时符合下列条件的同分异构体共有_______种。
①遇NaHCO3溶液有气体放出 ②芳香族化合物
其中不含甲基的有机物的结构简式为_________。
(6)有机物X可通过三步合成W,W是高分子化合物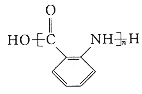 的单体。
的单体。
已知:Ⅰ.苯环上的甲基可以被酸性KMnO4氧化成羧基
Ⅱ.苯环侧链的硝基可被Fe/HCl还原为氨基,苯环侧链的氨基易被氧化
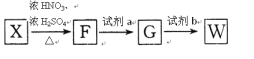
①F的结构简式为_______________,试剂a为_______________。
②在一定条件下W聚合成高分子化合物的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. 2NaHCO3![]() Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
C. 2KI+Br2=2KBr+I2 D. MgO+2HCl=MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com