
| A. | a+8+m-n | B. | a+16-m+n | C. | a+24-m-n | D. | a+18-m-n |
分析 同周期的两种主族元素A和B能够形成离子化合物AmBn,则A为金属元素,B为非金属元素,已知A的原子序数为a,则离子中A少了一个电子层,B的电子层不变,以此来解答.
解答 解:同周期的两种主族元素A和B能够形成离子化合物AmBn,则A为金属元素,B为非金属元素,已知A的原子序数为a,则离子中A少了一个电子层,B的电子层不变,
若在短周期,A的原子序数为a,则B的原子序数为(a-m)+8-n=a+8-m-n,
若在四、五周期,A的原子序数为a,则B的原子序数为(a-m)+18-n=a+18-m-n,
故选D.
点评 本题考查周期表的结构及应用,为高频考点,把握同周期形成离子化合物中最外层电子数相差8或18等为解答的关键,侧重分析与应用能力的考查,注意周期表结构的应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| 项目 | 实验目的 | 实验方案 |
| A | 验证稀硫酸和稀硝酸的氧化性强弱 | 将两块相同的铜片分别加入浓度均为2mol/L的硫酸和硝酸中,观察反应的难易程度 |
| B | 验证Cu、Fe的还原性强弱 | 将铁丝和铜丝分别插入浓硝酸中,观察反应的剧烈程度 |
| C | 验证Br、I非金属性强弱 | 将少量溴水加入KI-淀粉溶液中,观察溶液是否变蓝色 |
| D | 验证Mg、Al的金属性强弱 | 在Mg(OH)2、Al(OH)3中分别加入稀氨水,观察沉淀能否溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | -2 | +2 | +1 | +5,-3 | +7,-1 | +1 | +5,-3 | +3 |
| A. | ⑧号元素为Al | |
| B. | 上述八种元素最高价氧化物对应的水化物⑤号酸性最强 | |
| C. | ②、③处于同一周期 | |
| D. | ④元素的气态氢化物沸点大干⑦元素的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、 -2 | +2 | -2 | +1 |
| A. | K、L、M三元素的金属性逐渐增强 | |
| B. | T元素的化合价除了-2价,只有0价 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物为淡黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)<c(Cu2+)<c(H+)<c(SO42-) | B. | c(OH-)<c(H+)<c(SO42-)<c(Cu2+) | ||
| C. | c(OH-)<c(H+)<c(SO42-)=c(Cu2+) | D. | c(OH-)<c(H+)<c(Cu2+)<c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
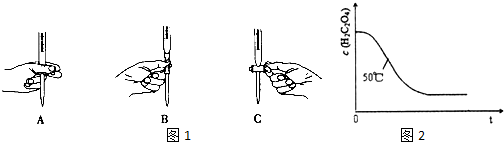
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响; b.实验1和3探究反应物浓度对该反应速率的影响; c.实验1和4探究催化剂对该反应速率的影响. | |
| 体积 (mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com