
【题目】将一定量的镁铝合金投入100 mL一定浓度的盐酸中,合金即溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成沉淀的质量与加入的NaOH溶液的体积如图所示,由图中数据分析计算:

(1)原合金中镁和铝的质量分别为多少?
(2)盐酸的物质的量浓度为多少?
【答案】(1)mMg=4.8g mAl=2.7g;(2)cHCl=8mol/L
【解析】
合金全部溶解,溶液中一定有Al3+和Mg2+,而H+可能含有;由图可知,加入NaOH溶液体积若小于20mL,溶液中没有沉淀出现,所以反应后的溶液中仍然剩余H+,所以从V(NaOH)=0mL至V(NaOH)=20mL,发生的是酸碱中和反应;V(NaOH)=20mL至V(NaOH)=160mL,则发生的是Al3+和Mg2+的沉淀反应;V(NaOH)=160mL时,溶液中的Al3+和Mg2+恰好沉淀完全,那么此时溶液中的溶质仅为NaCl,根据加入的NaOH的量即可最终求得盐酸的浓度;V(NaOH)=160mL至V(NaOH)=180mL,沉淀量在减少,所以发生的是Al(OH)3的溶解反应即:![]() ,由此可计算合金中Al的量,再结合V(NaOH)=20mL至V(NaOH)=160mL总共消耗的NaOH的量,就可间接求出合金中Mg的量。
,由此可计算合金中Al的量,再结合V(NaOH)=20mL至V(NaOH)=160mL总共消耗的NaOH的量,就可间接求出合金中Mg的量。
(1) 通过分析可知,V(NaOH)=160mL至V(NaOH)=180mL,发生Al(OH)3的溶解反应即:![]() ,所以合金中铝的质量为:
,所以合金中铝的质量为:![]() ;通过分析可知,V(NaOH)=20mL至V(NaOH)=160mL,发生的是Al3+和Mg2+的沉淀反应,Al3+的量为0.1mol需要消耗0.3molOH-,所以合金中镁的质量为:
;通过分析可知,V(NaOH)=20mL至V(NaOH)=160mL,发生的是Al3+和Mg2+的沉淀反应,Al3+的量为0.1mol需要消耗0.3molOH-,所以合金中镁的质量为:![]() ;
;
(2)通过分析可知,加入的NaOH体积为160mL时,溶液中的溶质仅为NaCl,所以原来盐酸的浓度为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液(E),某学生设计如下实验方案:

(1)操作①主要是将固体溶解,则所用的主要玻璃仪器是_______、_______。
(2)操作② ~ ④所加的试剂顺序可以为_______,_______,_______(填写试剂的化学式)。
(3)如何判断SO42-已除尽_____________
(4)实验过程中产生的多次沉淀_____(选填“需要”或“不需要”)多次过滤,理由是__________。
(5)该同学的实验设计方案中某步并不严密,请说明理由___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
(1)写出溴乙烷与NaOH水溶液共热的反应方程式:_______________,某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:____________________。
(2)写出溴乙烷与NaOH乙醇溶液共热的反应方程式:________,反应中生成的气体可以用如图所示装置检验,现象是______,水的作用是 ______。

(3)乙烯使溴水褪色的化学方程式: __________________________,X是比乙烯相对分子质量大14的乙烯的同系物,工业上用X生产塑料的化学方程式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将22.4 g铁粉逐渐加入含HNO3 0.8 mol的硝酸溶液中,反应生成的气体的物质的量(x)(假设HNO3的还原产物只有NO)随消耗铁粉的物质的量(y)变化关系中正确的是
A. 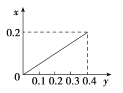 B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH、CO2+3H2
CH3OH、CO2+3H2![]() CH3OH+H2O,300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_________。
CH3OH+H2O,300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1mol/L酸性KMnO4溶液的体积/mL | 0.6mol/LH2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(1)表中V1=_______mL,V2=_______mL。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb。下列有关说法正确的是
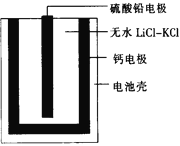
A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 电池总反应为Ca+PbSO4+2LiCl![]() Pb+Li2SO4+CaCl2
Pb+Li2SO4+CaCl2
D. 每转移0.2 mol电子,理论上消耗42.5 g LiCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com