
【题目】细胞中常见的化学元素有20多种,下列各组元素中,全是微量元素的是
A.Fe、Mn、Mo、S 、BB.Mo、Zn、Cu、B.、Fe
C.P、N、K、Ca、MgD.C、H、O、Ca、Mg
科目:高中化学 来源: 题型:
【题目】新型肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,其工作原理是N2H4+O2=N2+2H2O,电池放电时,电子由b极经外电路流向a极。下列有关该燃料电池的说法正确的是( )

A. 该装置中,X为N2H4,Y为空气
B. 负极的电极反应式:O2+2H2O+4e-=4OH-
C. 若电解质溶液为KOH溶液,则K+由右池通过交换膜向左池迁移
D. 电池工作时,b极附近溶液pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见金属的冶炼原理中不合理的是
金属 | 冶炼原理 | |
A | Fe | Fe2O3+3CO |
B | Hg | 2HgO |
C | Mg | MgO+H2 |
D | Na | 2NaCl(熔融) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol·L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2 =3V1,下列说法正确的是( )
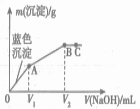
A. 原溶液中MgCl2和CuCl2的物质的量浓度相等
B. 该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小
C. 水的电离程度:A>B>C
D. 若向Mg(OH)2悬浊液中加入CuCl2溶液,一定会有Cu(OH)2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )
A. 乙烯、聚乙烯均能使溴水褪色
B.  和
和 互为同分异构体
互为同分异构体
C. 苯在催化剂作用下能与浓硝酸发生取代反应
D. 等质量的甲烷和乙烯完全燃烧,乙烯消耗的O2多![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
(1)工业上进行海水淡化有多种方法。
①蒸馏法是历史最久,技术和工艺比较成熟的海水淡化方法。下图是海水蒸馏装置示意图,仪器B的名称是_________。

②下图是膜分离技术进行海水淡化的原理示意图。水分子可以透过淡化膜,而海水中其他各种离子不能通过淡化膜。加压后,右侧海水中减少的是_______(填序号)。

a. 溶质质量 b. 溶液质量 c. 溶剂质量 d. 溶质的物质的量浓度
(2)碘在海水中主要以I-的形式存在,而在地壳中主要以IO3-的形式存在(几种粒子之间的转化关系如下图)。

①海水为原料按方法i制取I2的离子方程式是___________________。已知I2可以与Cl2继续反应生成IO3-,由该法制取I2时应注意控制的反应条件是_______。
②以方法ii在溶液中制取I2,反应的离子方程式是(已知:反应后所得溶液显酸性)________。
③上图iii中反应后溶液中IO3-和Cl-的个数比为1:6,则该反应中氧化剂和还原剂的物质的量之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(共6分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)![]() Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)该反应的氧化剂是 ,2molN2参加反应转移电子数为 。
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。

图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。
(3)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是
(提示:272 = 729)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com