
����Ŀ��(��6��)������(Si3N4)��һ�������մɲ��ϣ�������ʯӢ�뽹̿�ڸ��µĵ������У�ͨ�����·�Ӧ�Ƶã�3SiO2(s)+6C(s)+ 2N2(g)![]() Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
��1���÷�Ӧ���������� ��2molN2�μӷ�Ӧת�Ƶ�����Ϊ ��
��2���ﵽƽ��ı�ijһ������������ı�N2��CO����������Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ��

ͼ��t4ʱ����ƽ���ƶ������������� ��ͼ�б�ʾƽ��������CO�ĺ�����ߵ�һ��ʱ���� ��
��3�����÷�Ӧ��ƽ�ⳣ��Ϊ K��729������ͬ�¶���1L�ܱ������У�������SiO2��C��2mol N2��ַ�Ӧ����N2��ת������
(��ʾ��272 = 729)
���𰸡���1�������� 12NA��2�� �����¶Ȼ�����ѹǿ��t3~t4��(3 ) 50% ��
����������1�����ϼ۽��͵ķ�Ӧ��������������Ԫ�ػ��ϼ���0�۱仯Ϊ-3�ۣ����ϼ۽��ͣ����Ե�������������ÿ2molN2��Ӧ����ת��12mol������2molN2�μӷ�Ӧת�Ƶ�����Ϊ12NA�� �ʴ�Ϊ�� 12NA��
��2��t4ʱ���淴Ӧ���ʶ���ԭƽ��ʱ�����ʴ������¶Ȼ�����ѹǿ��t6ʱ���淴Ӧ���ʶ���ԭƽ��ʱ�����ʴ�ƽ�ⲻ�ƶ���ǰ�����廯ѧ������֮�Ͳ��ȣ�ֻ����ʹ�ô�������t4ʱ��Ӧ���淴Ӧ�����ƶ�����t3��t4ʱƽ��������CO�ĺ�����ߣ�
�ʴ�Ϊ�������¶Ȼ���С�����t3��t4��
��3 ���跴Ӧ��N2�����ʵ���Ϊx��
3SiO2(s)+6C(s)+ 2N2(g) ![]() Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
��ʼ�� 2mol 0
ת���� x 3x
ƽ�⣺ 2-x 3x
��ƽ��ʱN2��Ũ��Ϊ��2-x��mol/L��CO��Ũ��Ϊ3x mol/L�����У�![]() = 729����֮��x=1����N2��ת������1��2��100%=50%���ʴ�Ϊ��50%��
= 729����֮��x=1����N2��ת������1��2��100%=50%���ʴ�Ϊ��50%��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϸ���г����Ļ�ѧԪ����20���֣����и���Ԫ���У�ȫ����Ԫ�ص���
A.Fe��Mn��Mo��S ��BB.Mo��Zn��Cu��B.��Fe
C.P��N��K��Ca��MgD.C��H��O��Ca��Mg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.Ԫ�����ڱ��У��ڢ�A��Ԫ�غ͵ڢ�A��Ԫ�ص�ԭ��֮��ֻ���γ����Ӽ�
B.���л�ѧ�����ڲ������ڻ�ѧ��
C.CO2��SiO2�������������ܴ�������ͬ���͵Ļ�ѧ��
D.HF�����ȶ��Ժܺã�����ΪHF���Ӽ�����Ž�ǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨNaCl��Na2CO3��10H2O��NaHCO3�Ļ�����и���ֵĺ�����ijͬѧ�������ʵ����ȡһ�������Ļ���ͨ��������Ӧǰ��������װ�������ı仯���ⶨ�û�����и���ֵ���������������˵���������

A. �����������п�������ʢװ��ʯ�ҡ���ˮCaCl2����ʯ��
B. Ӳ�ʲ����ܼ���ǰ��Ӧ�ر�b����a������ͨ�������ֱ��a �������Ŀ�������ʹ����ʯ��ˮ�����Ϊֹ
C. ������װ�û���ʢ��NaOH��Һ��ϴ��ƿ�����õ�NaCl����ƫ��
D. ʵ�������һֱͨ�������ֹͣ���Ⱥ���ֹͣͨ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ����������Һ�У��ܴ��������������Ϊ
A.Na+��K+��SO42-��HS-B.Na+��K+��SiO32-��NO3-
C.Na+��K+��Cl-��SO42-D.Fe3+��NO3-��SO42-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ��˵����ȷ����(����)
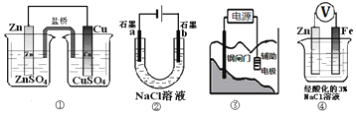
A. װ�â��У������е�Cl������CuSO4��Һ
B. װ�âڹ���һ��ʱ���a��������Һ��pH����
C. װ�â��и�բ��Ӧ����ӵ�Դ������������ñ���
D. װ�â��е�����Zn����������Fe��Zn������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȷ�Ϸ����˻�ѧƽ���ƶ�����
A����ѧ��Ӧ���ʷ����˸ı�
B������̬���ʲμӵĿ��淴Ӧ�ﵽƽ��ı���ѹǿ
C������ijһ�����ĸı䣬ʹƽ�������и���ֵ�Ũ�ȷ����˲�ͬ�̶ȵĸı�
D�����淴Ӧ�ﵽƽ���ʹ�ô���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��װ�ã�C��D��E��F��X��Y���Ƕ��Ե缫������Դ��ͨ����(��)�е����̪��Һ����F�������Ժ�ɫ��������˵����ȷ���� ( )
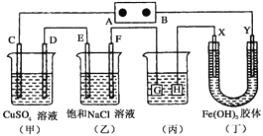
A. ��ԴB��������
B. (��)(��)װ�õ�C��D��E��F�缫���е������ɣ������ʵ�����Ϊ1:2:2:2
C. ����(��)װ�ø�ͭ������HӦ����Ag�����Һ��AgNO3��Һ
D. װ��(��)��Y���������ɫ��dz��˵���������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ܽ�Ȳ�ͬ����˿���������һ���ʣ�������Һ��pH���ﵽ����������ӵ�Ŀ�ġ����ܽ��������������ڲ�ͬpH�µ��ܽ��(S/mol/L)��ͼ��ʾ��

��1����pH��3ʱ����Һ��ͭԪ�ص���Ҫ������ʽ��__________��
��2����Ҫ��ȥCuCl2��Һ�е�����Fe3����Ӧ�ÿ�����Һ��pHֵΪ______ (�����)��
A����1����B��4���ҡ� C��8��PH��6 D����9
��3����Ni(NO3)2��Һ�к���������Co2�����ʣ�________(������������������)ͨ��������ҺpH�ķ�������ȥ��������_____________________________________________��
��4����֪һЩ���ܵ���ʵ��ܶȻ����������±���
���� | FeS | MnS | PbS | HgS | ZnS | CuS |
Ksp | 6.3��10��18 | 2.5��10��13 | 3.4��10��28 | 6.4��10��33 | 1.6��10��24 | 1.3��10��35 |
Ϊ��ȥij��ҵ��ˮ�к��е�Cu2����Pb2����Hg2�����ʣ���������˹�ҵ��ˮ�м��������___________(�����)��
A��NaOH�� ��B��FeS���� ��C��Na2S D��NH4Cl
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com