
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验步骤 | 实验现象 |
| ① | 用适量的蒸馏水溶解食盐,并将所得溶液分成2份 | |
| ② | 向第一份溶液中加入KSCN溶液,再加入氯水 | 溶液加入KSCN后无明显变化,加入氯水后变红 |
| ③ | 向第二份溶液中加入稀盐酸酸化,再加入足量KI固体,最后加入淀粉溶液 | 溶液变蓝 |
| 实验编号 | 1 | 2 | 3 |
| Na2S2O3溶液的体积/mL | 14.98 | 15.00 | 15.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 2MoO3+4SO2 ②MoO3+2NH3?H2O=(NH4)2MoO4+H2O
2MoO3+4SO2 ②MoO3+2NH3?H2O=(NH4)2MoO4+H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
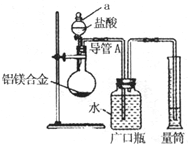 含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.
含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案. 测定生成气体在标准状况下的体积(V1L)
测定生成气体在标准状况下的体积(V1L) 充分反应后测定剩余固体的质量(W1g)
充分反应后测定剩余固体的质量(W1g) 溶液
溶液 过滤,测定沉淀的质量(W2g)
过滤,测定沉淀的质量(W2g) 测定生成气体在标准状况下的体积(V2L).
测定生成气体在标准状况下的体积(V2L).查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com