
| A. | 当x≤n时,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 当x≥$\frac{3n}{2}$时,反应的离子方程式为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 当n≤x≤$\frac{3n}{2}$时,反应中转移电子的物质的量n(e-)为2nmol≤n(e-)≤3nmol | |
| D. | 当n<x<$\frac{3n}{2}$时,溶液中Fe3+、Cl-、I2的物质的量之比为2(x-n):x:n |
分析 氧化性Fe3+>I2,则还原性为I->Fe2+,当x≤n时,只有碘离子被氧化;x=n时,碘离子恰好完全反应;当x≥$\frac{3n}{2}$时,碘离子、亚铁离子全部被氧化;当n<x<$\frac{3n}{2}$时,碘离子全部被氧化,亚铁离子部分被氧化,以此来解答.
解答 解:A.当x≤n时,只有碘离子被氧化,反应的离子方程式为2I-+Cl2=I2+2Cl-,故A错误;
B.当x≥$\frac{3n}{2}$时,碘离子、亚铁离子全部被氧化,离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,故B错误;
C.当n≤x≤$\frac{3n}{2}$时,碘离子全部被氧化,亚铁离子部分被氧化,所以反应中转移电子的物质的量n(e-)为2nmol≤n(e-)≤3nmol,故C正确;
D.当n<x<$\frac{3n}{2}$时,碘离子全部被氧化,亚铁离子部分被氧化,则溶液中Fe3+、Cl-、I2的物质的量之比为(x-n):x:n,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断及氧化还原反应,为高频考点,把握发生的化学反应及氧化的先后顺序为解答的关键,侧重氧化还原反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42- | |
| B. | 向某溶液中加入足量的盐酸,放出二氧化碳气体,可证明该溶液中一定含有CO32- | |
| C. | 用洁净铁丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+ | |
| D. | 向某溶液滴加NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,可确定原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应(1)和(2)均为氧化还原反应 | |
| B. | 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3 | |
| C. | 高温下,O2的氧化性大于Fe2O3小于Na2CrO4 | |
| D. | 生成1mol的Na2Cr2O7时共转移5mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | X、Z、W元素的原子半径依次递增 | |
| B. | T元素的非金属性比Z弱 | |
| C. | YX2晶体熔化、液态WX3气化均需克服分子间作用力 | |
| D. | Y、Z、W元素在自然界中均不能以游离态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,22.4L的Cl2与足量水反应中电子转移了2NA | |
| B. | 0.1mol/LK2SO4溶液中含有0.2NA个阳离子 | |
| C. | 常温常压下,22.4LO2气体的分子数小于NA | |
| D. | 20g D2O所含的中子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C4H6 | B. | C2H2、C4H8 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
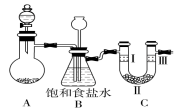 某学习小组围绕氯气设计了一系列实验.
某学习小组围绕氯气设计了一系列实验.| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com