
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2 g铜。
①请写出铜与稀硝酸反应的离子反应方程式 。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有 。
③仪器c中收集的气体主要是 。(填分子式)
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是 g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用a mol Fe和含有b mol HNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。则
①反应结束后的溶液中NO3-的物质的量的取值范围是 。(用含a的代数式等表示)
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+)∶n(Fe2+) 为3∶1,则b/a的值为 。
(1)①3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑ ② 酸性和强氧化性 ③ NO ④ 4.9g
(2)① 2a <n<3a ②11/3
解析试题分析:(1)①3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑
② 在反应中即生成了硝酸铜又生成了NO气体。所以体现了硝酸的酸性和强氧化性。
③ NO不溶于水,但可与空气反应。所以应采用排水法收集。
④因为n(Cu)=3.2g÷64g/mol=0.05mol.利用原子守恒,可以推得n(Cu(OH)2)=0.05mol 。所以m(Cu(OH)2)=0.05mol*98g/mol=4.9g
(2)①因为反应后产物中是Fe(NO3)和Fe(NO3)2 。利用极端假设,若全部生成Fe(NO3)3,则a mol Fe(NO3)3 中NO3-的物质的量为3a mol .若全部生成Fe(NO3)2 ,则a mol Fe(NO3)2 中NO3-的物质的量为2a mol。
②因为发生的反应有Fe+4HNO3=Fe(NO3)3+NO+2H2O 和 3Fe+8HNO3=3Fe(NO3)2+2NO+4H2O 。又因为n(Fe3+)∶n(Fe2+) 为3∶1,可以假设n(Fe3+)=3mol, n(Fe2+)=1mol。带入方程式求出n(HNO3)=12+8/3=44/3mol。而利用原子守恒反应物中n(Fe)=3+1=4mol.。则二者的物质的量之比为11/3
考点:掌握实验室制取NO的原理和有关硝酸的计算。掌握Fe和HNO3反应的过程。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
实验室用图I所示的装置制取干燥的氨气。
(1)A处反应的化学方程式为 。
(2)为收集到干燥的氨气,导管C应接 (填序号)。
(3)装置B中盛装的试剂的名称是 。
(4)在水槽中加入水(含酚酞),将充满氨气的试管倒置于放入水槽中(如图Ⅱ所示),将拇指稍移开试管口,可观察到的现象为_______________ 。
(5)在D、E、F三种气体收集方法中,能用于收集NO的是________(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O。
① 该反应中氧化剂和还原剂的物质的量之比是 。
② 研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
许多含氯物质与生活密切相关,如HC10、C102、NaClO2等都是重要的杀菌消毒剂和漂白剂。下列是重要的含氯漂白剂NaClO2的工业合成流程图。
已知:纯ClO2易发生爆炸。请回答下列问题:
(1) 在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是____________。
(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可以选择的还原剂是______(填代号)。
a.Na2O2 b.Na2S c.FeCl2 d.铁粉
(3)NaClO2溶液与FeCl2溶液相遇,有大量红褐色沉淀产生,该反应的离子方程式为______
(4)为了测定NaClO2 ? 3H2O的纯度,取上述合成产品10 g溶于水配成500 mL溶液,取出10 mL溶液于锥形瓶中,再加人足量酸化的KI溶液,充分反应后加人2 ~3滴淀粉溶液,用0.264 mol/L Na2S2O3标准液滴定,锥形瓶中溶液______(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.OOmL,试样纯度是否合格______(填“合格”或“不合格”,合格纯度在90%以上)。提示: 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫及其化合物在自然界普遍存在、容易转化。
Ⅰ.火山喷发、生物质降解时产生的有毒气体H2S、SO2等进入大气后,因一些自然转化而得以消除。如
(1)H2S和SO2分子碰撞时,污染会降低。反应方程式为_________________________。
(2)H2S在常温下,会被空气逐渐氧化,反应方程式为_________________________。
(3)SO2在飘尘催化下,会被空气氧化为SO3,遇水生成硫酸,硫酸遇石灰岩转化为稳定的石膏矿物(CaSO4·2H2O)。SO2被氧化的化学方程式为_____________________________。
在环保措施上,这会给我们带来“师法自然”的启示。
Ⅱ.人为过度排放二氧化硫等,会超出自然净化吸收能力,带来严重环境污染。“石灰-石膏法”和“烧碱法”是工业上常用的工业烟气脱硫法。
(4)“石灰-石膏法”吸收二氧化硫的流程为:
由SO2等生成石膏的总化学方程式为________________________________________。
(5)“烧碱法”是用氢氧化钠浓溶液吸收含二氧化硫的烟气,其优点是氢氧化钠碱性强、吸收快、效率高。化学方程式为______________________________________。但烧碱的价格较贵(石灰0.36元/kg,烧碱2.90元/kg)。
(6)若将“石灰-石膏法” 和“烧碱法”结合起来对烟气脱硫,则会产生快速高效低成本无污染的好效果,最终仍得到石膏产品。请在下列流程图的①~④处填写物质的化学式:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)直接排放氮氧化物会形成酸雨、雾霾,催化还原法和氧化吸收法师常用的处理方法。
(1)用化学方程式表示NO2形成酸雨的过程____________________________
(2)利用NH3和CH4等气体除去烟气中的氮氧化物。
①NH3的电子式
②热稳定性 NH3 CH4(填“>”=“<”)
③已知:CH4(g)+2O2(g)=CO2(g)+2H20(l) △H1=akJ/mol; 欲计算反应CH4(g)+4NO(g)=CO2(g)+2H20(l)+2N2(g)的焓变 △H2则还需要查询某反应的焓变△H3,当反应中各物质的化学计量数之比为最简整数比时,△H3=bkJ/mol,该反应的热化学方程式是__________________________据此计算出△H2= kJ/mol (用含a、b的式子表示)。
(3)利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式______________________________________现有标况下的O233.6ml,理论上可以处理该氮氧化物______ml(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅在元素周期表中的位置是_______。
(2)工业生产粗硅的反应有:SiO2+2C Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
(3)工业上可以通过如下图所示的流程制取纯硅: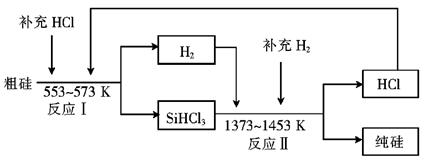
①若反应I为 Si(粗)+3HCl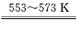 SiHCl3+H2,
SiHCl3+H2,
则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
图①-?分别代表有关反应中的一种物质,请填下以下空白。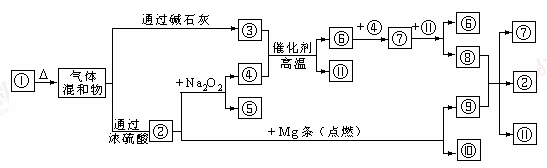
(1)①、④的化学式分别是______、______。
(2)用电子式表示②的形成过程为 ;
(3)⑧与⑨反应的化学方程式是______;检验③的存在的方法是 。
(4)Mg也可以与⑧的稀溶液反应生成⑥,写出反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)化学小组同学依据化学反应Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。
ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。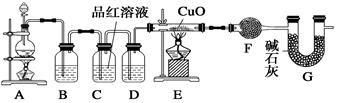
请回答下列问题:
(1)装置A中添加液体的仪器名称为 ;98%的浓H2SO4(ρ=1.84 g/cm3)的物质的量浓度是 ;
(2)请写出产生氢气的反应的离子方程式 ;
(3)①装置B是为了吸收SO2,则不能选用下列试剂中的 (填序号);
A.NaOH溶液 B.浓H2SO4 C.KMnO4溶液
②可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有氢气的实验现象是 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com