
许多含氯物质与生活密切相关,如HC10、C102、NaClO2等都是重要的杀菌消毒剂和漂白剂。下列是重要的含氯漂白剂NaClO2的工业合成流程图。
已知:纯ClO2易发生爆炸。请回答下列问题:
(1) 在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是____________。
(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可以选择的还原剂是______(填代号)。
a.Na2O2 b.Na2S c.FeCl2 d.铁粉
(3)NaClO2溶液与FeCl2溶液相遇,有大量红褐色沉淀产生,该反应的离子方程式为______
(4)为了测定NaClO2 ? 3H2O的纯度,取上述合成产品10 g溶于水配成500 mL溶液,取出10 mL溶液于锥形瓶中,再加人足量酸化的KI溶液,充分反应后加人2 ~3滴淀粉溶液,用0.264 mol/L Na2S2O3标准液滴定,锥形瓶中溶液______(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.OOmL,试样纯度是否合格______(填“合格”或“不合格”,合格纯度在90%以上)。提示: 。
。
(1)用pH试纸检验 (2)a (3)否 SO2能与ClO2、NaOH、H2O2发生化学反应
(4)3ClO- + 12Fe2+ +6H2O=4Fe(OH)3+3Cl- +8Fe2+ (5)蓝色变为无色 合格
解析试题分析:
(1)检验溶液的酸碱性最简单的方法可用PH试纸检验,故答案为:用pH试纸检验溶液的pH;
(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可用Na2O2 , 而其它还原剂都能引入新的杂质,只有a符合,
(3)红褐色沉淀应为Fe(OH)3沉淀,反应物为ClO2-和Fe2+,生成物有Fe(OH)3,根据氧化还原反应得失电子守恒和质量守恒可写出反应的化学方程式为3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+,
(5)取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,发生ClO2-+4I-+4H+=Cl-+2I2+2H2O,充分反应后加入2~3滴淀粉溶液,溶液变蓝,用0.264mol/L Na2S2O3标准液滴定,发生:2Na2S2O3+I2═Na2S4O6+2NaI,蓝色变为无色,
可得反应的关系式为:ClO2-~2I2~4Na2S2O3,又n(Na2S2O3)=0.264mol/L×0.02L=0.00528mol,
则
ClO2-~2I2~4Na2S2O3
1 4
n(ClO2-) 0.00528mol
n(ClO2-)=0.00528mol/4=0.00132mol,
所以500ml溶液中含有:n(NaClO2)=0.00132mol×50=0.066mol,
则10g合成产品中含有:m(NaClO2?3H2O)=0.066mol×144.5g/mol=9.537g,
则ω(NaClO2?3H2O)=9.527/10g×100%=95.27%>90%,所以产品合格,
考点:本题考查较为综合,涉及物质的检验、除杂、制备以及含量的测定,题目难度较大,本题(5)为易错点,注意把握有关反应方程式的书写。


科目:高中化学 来源: 题型:填空题
A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质。
请填空:
(1)形成单质A的元素,在化合物中的最高化合价为 。
(2)B和碳反应生成A和E的化学方程式是 。
(3)C的化学式为 ,D 的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢溴酸(HBr)是一种与盐酸化学性质相似的物质,阳离子相同的溴盐与氯盐溶解性也比较相似,现有以下六种物质:Fe、Fe2O3、CO2、Cu(OH)2、CaCO3、Na2SO4,请从中选取物质,写出能与氢溴酸反应的化学方程式(可不填满,不反应的写出倒扣1分,本题扣到0分为止):
(1)
(2)
(3)
(4)
(5)
(6)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。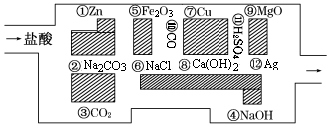
(1)请你帮助它走出迷宫(请用图中物质前的序号表示):____________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有 个。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。根据
题意完成下列计算:
联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮
原子的质量分数为0.977,计算确定该氢化物的分子式为 。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积 L。
联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物
是氮气和水。由联氨和四氧化二氮组成的火箭推进剂恰好完全反应生成72.0 kg水,推进剂中联氨的质量为 kg。
氨的水溶液可用于吸收NO与NO2混合气体,可消除氮氧化合物对环境的污染。请分
别写出有关的反应方程式为: ; 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2 g铜。
①请写出铜与稀硝酸反应的离子反应方程式 。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有 。
③仪器c中收集的气体主要是 。(填分子式)
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是 g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用a mol Fe和含有b mol HNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。则
①反应结束后的溶液中NO3-的物质的量的取值范围是 。(用含a的代数式等表示)
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+)∶n(Fe2+) 为3∶1,则b/a的值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有 (填写字母编号)
A水体富营养化 B重金属污染 C雾霾 D酸雨
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式 。
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
A的化学式 ,若生成ag A,理论上可以回收SO2的质量为 g。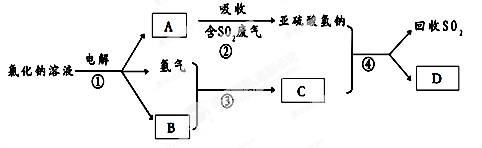
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式 。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
N2在化工生产、农业、医疗、航天航空等领域用途广泛。现提供以下装置(连接仪器略去):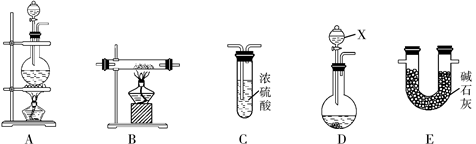
①某化学兴趣小组甲同学欲用加热NaNO2和NH4Cl的浓溶液制得N2,应该选择的发生装置是 ,在添加药品、制取气体前必须进行的操作是 。
②在加热条件下,用NH3还原CuO可制得N2,同时获得铜粉,此反应的化学反应方程式是 。
③乙同学利用②中反应原理制备干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料。按气流从左到右的连接顺序是D→E→B→C,其中装置D中仪器X的名称是 。装置C中试剂的作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com