
氢溴酸(HBr)是一种与盐酸化学性质相似的物质,阳离子相同的溴盐与氯盐溶解性也比较相似,现有以下六种物质:Fe、Fe2O3、CO2、Cu(OH)2、CaCO3、Na2SO4,请从中选取物质,写出能与氢溴酸反应的化学方程式(可不填满,不反应的写出倒扣1分,本题扣到0分为止):
(1)
(2)
(3)
(4)
(5)
(6)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2+H2O??H++Cl-+HClO,其平衡常数表达式为K=________。
(2)工业上常用熟石灰和氯气反应制取漂白粉,反应的化学方程式是____________________________。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入,这样加料的目的是__________________________。处理从氯化塔中逸出气体的方法是________。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是____________________________________,其原因可能是__________________,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下: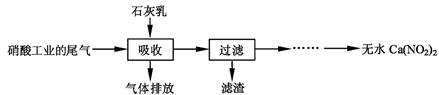
请回答下列问题:
(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)  N2O3(g),其平衡常数表达式为K= 。
N2O3(g),其平衡常数表达式为K= 。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是 ;滤渣可循环利用,滤渣的主要成分是 (填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1︰1。若n(NO):n(NO2)>1︰1,则会导致 ;若n(NO):n(NO2)<1︰1,则会导致 。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O。
① 该反应中氧化剂和还原剂的物质的量之比是 。
② 研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化荆和催化剂等。
工业制硫酸铜的方法很多。
(1)方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_____________________,此法的最大缺点是____________________________。
(2)方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示: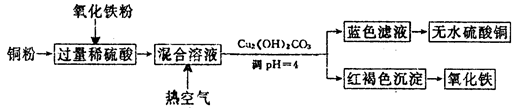
①稀硫酸、铜和氧化铁反应的离子方程式是__________________、________________;
向混合溶液中通入热空气的反应的离子方程式是_______________________________。
②请说出调整PH为4的目的是_______________________;由滤液得到无水硫酸铜的实验操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
许多含氯物质与生活密切相关,如HC10、C102、NaClO2等都是重要的杀菌消毒剂和漂白剂。下列是重要的含氯漂白剂NaClO2的工业合成流程图。
已知:纯ClO2易发生爆炸。请回答下列问题:
(1) 在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是____________。
(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可以选择的还原剂是______(填代号)。
a.Na2O2 b.Na2S c.FeCl2 d.铁粉
(3)NaClO2溶液与FeCl2溶液相遇,有大量红褐色沉淀产生,该反应的离子方程式为______
(4)为了测定NaClO2 ? 3H2O的纯度,取上述合成产品10 g溶于水配成500 mL溶液,取出10 mL溶液于锥形瓶中,再加人足量酸化的KI溶液,充分反应后加人2 ~3滴淀粉溶液,用0.264 mol/L Na2S2O3标准液滴定,锥形瓶中溶液______(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.OOmL,试样纯度是否合格______(填“合格”或“不合格”,合格纯度在90%以上)。提示: 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)直接排放氮氧化物会形成酸雨、雾霾,催化还原法和氧化吸收法师常用的处理方法。
(1)用化学方程式表示NO2形成酸雨的过程____________________________
(2)利用NH3和CH4等气体除去烟气中的氮氧化物。
①NH3的电子式
②热稳定性 NH3 CH4(填“>”=“<”)
③已知:CH4(g)+2O2(g)=CO2(g)+2H20(l) △H1=akJ/mol; 欲计算反应CH4(g)+4NO(g)=CO2(g)+2H20(l)+2N2(g)的焓变 △H2则还需要查询某反应的焓变△H3,当反应中各物质的化学计量数之比为最简整数比时,△H3=bkJ/mol,该反应的热化学方程式是__________________________据此计算出△H2= kJ/mol (用含a、b的式子表示)。
(3)利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式______________________________________现有标况下的O233.6ml,理论上可以处理该氮氧化物______ml(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验。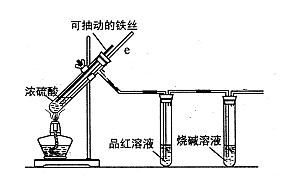
(1)写出铁与浓硫酸反应的化学方程式 ;
若在取用浓硫酸的过程中,不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)品红溶液的作用是 。
(4)小组讨论后认为:由于常用的铁丝是铁碳合金,生成的气体中还可能含有CO2。写出生成CO2的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com