
“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。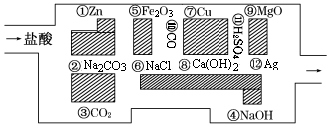
(1)请你帮助它走出迷宫(请用图中物质前的序号表示):____________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有 个。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
A-G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色,C是红色的金属单质。它们之间有如下转化关系(其中反应③④⑦的产物中的水已略去)。试填空
(1)B的化学式________。
(2)反应⑤中氧化剂与还原剂的物质的量之比为 。
(3)写出反应⑦的离子方程式_____________________。
(4)写出电解X溶液的阳极反应式______________________;若电解一段时间后转移了0.2mol电子,则此时电解产生的气体在标准状况下的体积为 。
(5)写出反应④的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O。
① 该反应中氧化剂和还原剂的物质的量之比是 。
② 研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaC1O2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖,油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaC1O2的溶解度随温度升高而增大,适当条件下可结晶析出NaC1O2·3H2O.
②纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
I.请根据上述流程回答下列问题
(1)发生器中鼓入空气的作用可能是
(2)吸收塔内的反应的化学方程式为 .吸收塔的温度不能超过20℃,其目的是 .
(3)在碱性溶液中NaC1O2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 .
(4)从滤液中得到NaC1O2·3H2O粗晶体的实验操作依次是 .
II.上述流程中的原料NaC1O3可由氯气通入热的烧碱溶液后重结晶就得到比较纯净的产品,所以通常工厂联合氯碱车间制备.
(1)氯碱工业中的原料为 ,原料需要净化的原因是 ,阳极产品为
(2)工业生产NaC1O3的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
许多含氯物质与生活密切相关,如HC10、C102、NaClO2等都是重要的杀菌消毒剂和漂白剂。下列是重要的含氯漂白剂NaClO2的工业合成流程图。
已知:纯ClO2易发生爆炸。请回答下列问题:
(1) 在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是____________。
(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可以选择的还原剂是______(填代号)。
a.Na2O2 b.Na2S c.FeCl2 d.铁粉
(3)NaClO2溶液与FeCl2溶液相遇,有大量红褐色沉淀产生,该反应的离子方程式为______
(4)为了测定NaClO2 ? 3H2O的纯度,取上述合成产品10 g溶于水配成500 mL溶液,取出10 mL溶液于锥形瓶中,再加人足量酸化的KI溶液,充分反应后加人2 ~3滴淀粉溶液,用0.264 mol/L Na2S2O3标准液滴定,锥形瓶中溶液______(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.OOmL,试样纯度是否合格______(填“合格”或“不合格”,合格纯度在90%以上)。提示: 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫及其化合物在自然界普遍存在、容易转化。
Ⅰ.火山喷发、生物质降解时产生的有毒气体H2S、SO2等进入大气后,因一些自然转化而得以消除。如
(1)H2S和SO2分子碰撞时,污染会降低。反应方程式为_________________________。
(2)H2S在常温下,会被空气逐渐氧化,反应方程式为_________________________。
(3)SO2在飘尘催化下,会被空气氧化为SO3,遇水生成硫酸,硫酸遇石灰岩转化为稳定的石膏矿物(CaSO4·2H2O)。SO2被氧化的化学方程式为_____________________________。
在环保措施上,这会给我们带来“师法自然”的启示。
Ⅱ.人为过度排放二氧化硫等,会超出自然净化吸收能力,带来严重环境污染。“石灰-石膏法”和“烧碱法”是工业上常用的工业烟气脱硫法。
(4)“石灰-石膏法”吸收二氧化硫的流程为:
由SO2等生成石膏的总化学方程式为________________________________________。
(5)“烧碱法”是用氢氧化钠浓溶液吸收含二氧化硫的烟气,其优点是氢氧化钠碱性强、吸收快、效率高。化学方程式为______________________________________。但烧碱的价格较贵(石灰0.36元/kg,烧碱2.90元/kg)。
(6)若将“石灰-石膏法” 和“烧碱法”结合起来对烟气脱硫,则会产生快速高效低成本无污染的好效果,最终仍得到石膏产品。请在下列流程图的①~④处填写物质的化学式:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅在元素周期表中的位置是_______。
(2)工业生产粗硅的反应有:SiO2+2C Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
(3)工业上可以通过如下图所示的流程制取纯硅: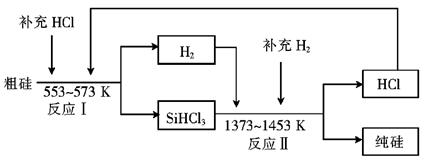
①若反应I为 Si(粗)+3HCl SiHCl3+H2,
SiHCl3+H2,
则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)固体硝酸盐加热易分解且产物较复杂。以Mg(NO3)2为研究对象,四个学习小组拟通过实验探究其热分解的产物,分别提出如下4种猜想:
甲组:Mg(NO2)2、NO2、O2 乙组:MgO、NO2、O2
丙组:MgO、NO2、N2 丁组:Mg3N2、O2
(1)实验前,小组成员经讨论认定 组的猜想一定不成立,理由是_____________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对其他小组猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略)进行探究: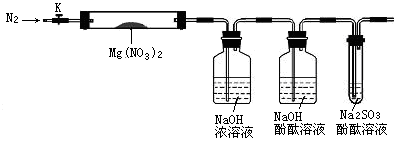
A B C D
(2)实验过程
①简述检验该装置气密性的方法 。
②称取硬质试管A的质量为18.0g,试管A与Mg(NO3)2固体共21.8 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 然后固定在管中固体部位下加热。
③观察到A中有红棕色气体生成,C中有气泡。
④待样品完全分解,A装置冷却至室温、称量,测得硬质试管A和剩余固体的总质量为19.0g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①证明一定有O2生成的依据是 ,与此相关的化学原理为(用化学方程式表示) 。
根据实验现象和剩余固体的质量经分析可初步确认猜想_______组结论是正确的。
②一位同学认为上述装置不能确认分解产物中有O2,他的理由你认为可能是 , 如果需改进装置,应该 。
(4)据以上分析,Mg(NO3)2分解的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是 ( )。
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变 红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com