
某铝合金中含有单质铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验流程,请回答有关问题: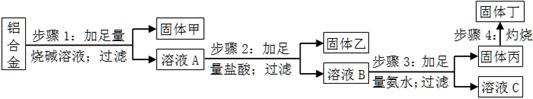
(1)步骤1所得固体甲的成分为 。
(2)步骤2中加足量盐酸,而不采用通入足量二氧化碳的原因为 。
(3)步骤3中生成固体丙的离子方程式为 ;溶液C中所含有的阳离子符号为 。
(4)步骤4所发生反应的化学方程式为 。
(5)现用托盘天平称取10.0g铝合金进行上述流程图所示操作,所得固体丁质量为15.3g,则该铝合金中铝的质量分数为 ;并判断以下操作对铝质量分数测定的影响(填“偏大”、“偏小”或“无影响”)。
a.步骤1中烧碱量不足,则 ;
b.步骤4中灼烧不充分,则 。
(16分)
(1)镁、铜(2分)
(2)通入二氧化碳得到硅酸与氢氧化铝的固体混合物,无法将硅、铝元素分离开来。(2分)
(3)Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+(3分);Na+、NH4+(2分)
(4)2Al(OH)3 Al2O3 + 3H2O(3分)
Al2O3 + 3H2O(3分)
(5)81.0%(2分);偏小(1分);偏大(1分)
解析试题分析:(1)镁、铜不与烧碱溶液反应,故固体甲的成分为镁、铜。
(2)氢氧化铝沉淀可以和盐酸反应,而不能和二氧化碳反应,故不采用通入足量二氧化碳的原因是通入二氧化碳得到硅酸与氢氧化铝的固体混合物,无法将硅、铝元素分离开来。
(3)氢氧化铝沉淀不再与氨水反应,故步骤3中生成固体丙的离子方程式为Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+。溶液C中所含有的阳离子符号为Na+、NH4+。
(4)丙是氢氧化铝,故反应方程式为2Al(OH)3 Al2O3 + 3H2O。
Al2O3 + 3H2O。
(5)Al→1/2Al2O3
27g 51g
m 15.3g
51g×m=27g×15.3g
解得m=8.1g
故10.0g铝合金中铝的质量分数为81.0%。
a.步骤1中烧碱量不足,Al反应不完,故偏小。
b.步骤1中灼烧不充分,丁的质量将偏大,故铝质量分数测定要偏大。
考点:探究物质的组成或测量物质的含量 铝的化学性质
点评:本题考查学生对实验与操作原理、物质的分离提纯、物质含量的测定、化学计算等,难度中等,清楚实验原理是解题的关键,是对所学知识的综合运用,需要学生具备扎实的基础与运用知识分析问题解决问题的能力。


科目:高中化学 来源: 题型:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省牡丹江一中高一下学期期末考试化学试卷(带解析) 题型:实验题
Ⅰ.某同学做“铝热反应”的实验。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | —— |
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省高一下学期期末考试化学试卷(解析版) 题型:实验题
Ⅰ.某同学做“铝热反应”的实验。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
—— |
铝热反应方程式为 .
下列能与Al发生铝热反应的有 。(填序号)
A、MnO2 B、Na2O C、MgO D、FeO
据上表数据该同学推测,铝热反应所得到的熔融物应是铁铝合金。若证明上述所得的块状熔融物中含有金属铝,所用试剂是 ,该试剂溶质的电子式为 。
Ⅱ.某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的实验仪器有
_______________等。(填代号,下同)
A、试管;B、坩埚;C、烧杯;D、三角架;E、泥三角;F、洒精灯;G、铁架台;H、量筒
第2步:Iˉ溶液的获取。操作是将灰烬转移到烧杯中,加适量蒸馏水,用玻棒充分搅拌,煮沸,冷却,________。(填分离方法)
(3)第3步:氧化。取(2)中溶液少量依次加入合适的试剂。下列氧化剂最好选_________。
A、浓硫酸 B、新制氯水 C、KMnO4溶液 D、H2O2
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加_______溶液,证明海带中含碘。
查看答案和解析>>
科目:高中化学 来源:2015届福建霞浦一中高一下学期第一次月考化学试卷(解析版) 题型:实验题
某铝合金中含有单质铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验流程,请回答有关问题:
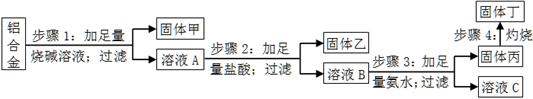
(1)步骤1所得固体甲的成分为 。
(2)步骤2中加足量盐酸,而不采用通入足量二氧化碳的原因为 。
(3)步骤3中生成固体丙的离子方程式为 ;溶液C中所含有的阳离子符号为 。
(4)步骤4所发生反应的化学方程式为 。
(5)现用托盘天平称取10.0g铝合金进行上述流程图所示操作,所得固体丁质量为15.3g,则该铝合金中铝的质量分数为 ;并判断以下操作对铝质量分数测定的影响(填“偏大”、“偏小”或“无影响”)。
a.步骤1中烧碱量不足,则 ;
b.步骤4中灼烧不充分,则 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com