
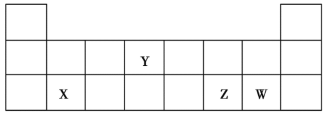
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 均为短周期元素,它们在周期表中的相对位置如图所示。下列说法正确的是
均为短周期元素,它们在周期表中的相对位置如图所示。下列说法正确的是
A.原子半径:![]()
B.简单氢化物的稳定性:![]()
C.元素![]() 与元素
与元素![]() 可形成化合物
可形成化合物![]() ,且
,且![]() 是共价化合物
是共价化合物
D.由简单氢化物水溶液的酸性:![]() ,可推知元素的非金属性:
,可推知元素的非金属性:![]()
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①盐卤(含MgCl2)![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() 无水MgCl2
无水MgCl2
②铝土矿![]() AlO2-
AlO2-![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3
③NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
④NaCl溶液![]() Cl2
Cl2![]() 无水FeCl2
无水FeCl2
⑤S![]() SO3
SO3![]() H2SO4
H2SO4
⑥SiO2![]() Na2SiO3溶液
Na2SiO3溶液![]() H2SiO3
H2SiO3
A. ③⑥B. ③⑤⑥C. ①④⑤D. ①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、W的原子序数依次增加。m、P、r是由这些元素组成的二元化合物,n是W的单质,q是Y的单质,s是Z的单质且常温下为淡黄色固体,m 与r相遇会产生白烟。上述物质的转化关系如图所示。下列说法错误的是

A. 原子半径:z>W>X
B. Y的一种氢化物可作为制冷剂
C. Z的氧化物对应的水化物酸性一定比W的弱
D. X、Y、W三种元素组成的化合物可为离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:[已知Ba(HCO3)2可溶于水]
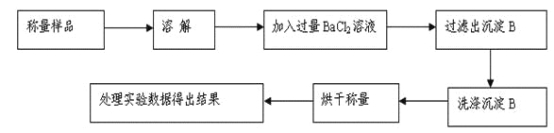
(1)实验时,过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为_____________。
(2)洗涤沉淀B的操作是___________________________________________________。
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为____________。
方案Ⅱ.乙组同学的主要实验流程图如下:
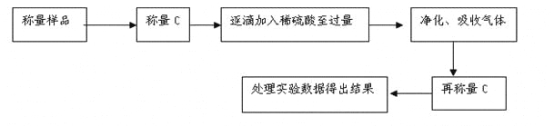
按如下左图所示装置进行实验:
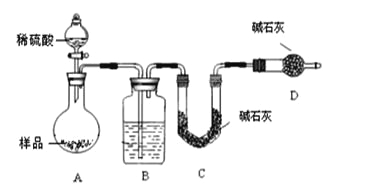
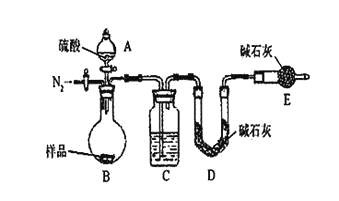
(4)该实验中装置B盛放的物质是_____________________,分液漏斗中__________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(5)在C中装碱石灰来吸收净化后的气体。
①样品中碳酸钠的质量分数越大,则实验中干燥管C在充分吸收气体前后的质量差____________________。(填“越大”、“越小”或“不变化”)
②D装置的作用是_________________________。
(6)有同学认为为了减少实验误差,在反应前后都要通入N2(如上右图),反应后通入N2的目的是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为几种短周期元素的性质:
元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径 | 66 | 160 | 152 | 110 | 99 | 186 | 70 | 88 |
最高化合价 |
|
|
|
|
|
|
| |
最低化合价 |
|
|
|
|
下列有关上述元素的说法正确的是
A.元素⑤的氢化物的沸点高于元素①的氢化物的沸点
B.②⑦形成的化合物为共价化合物
C.上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤
D.元素⑧位于周期表中第3周期ⅢA族
查看答案和解析>>
科目:高中化学 来源: 题型:
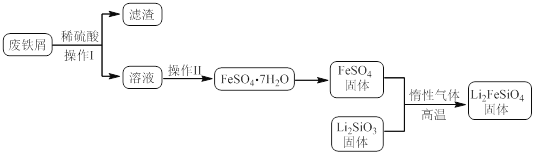
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
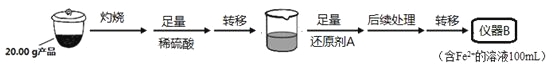
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g)CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
A.K2和K1的单位均为mol·L-1B.K2<K1
C.c2(CO)>c2(H2O)D.c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
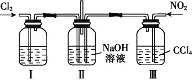
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钙原子的结构示意图为_____。
(2)氧离子电子式为_____。
(3)0℃,1atm时,CO2的气体摩尔体积约为_____L/mol。
(4)1个普通水分子的质量大约是_____g。
(5)常温下,水的摩尔体积约为_____cm3/mol。
(6)已知n个12C原子的质量是a克,则m个32S原子的质量约是_____。
(7)电解饱和食盐水的方程式为_____;工业制漂白粉的方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com