
【题目】下列各组顺序的排列不正确的是( )
A. 熔点:金刚石>干冰 B. 稳定性:SiH4>H2S
C. 碱性:KOH>Al(OH)3 D. 离子半径:O2->Na+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X 是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
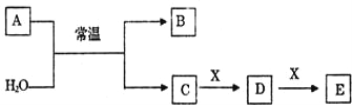
(1)若 A 为常见的金属单质,焰色反应呈黄色,X 能使品红溶液褪色,写出 C 和 E 反应的离子方程式:______________________________。
(2)若 A 为淡黄色粉末,X 为一种最常见的造成温室效应的气体。则鉴别等浓度的 D、E 两种溶液,可 选择的试剂为_____(填代号)。
A.盐酸 B.BaCl2 溶液 C.Ca(OH)2 溶液
(3)若 A 为非金属氧化物,X 是 Fe,溶液 D 中加入 KSCN 溶液变红。则 A 与 H2O 反应的化学反应方程 式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(C12H15ClO3)为含多种官能团的芳香族化合物,其结构简式如图所示(其中虚线框内为未知部分的结构),A可发生如下转化(其中部分产物已略去)。
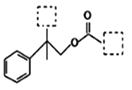
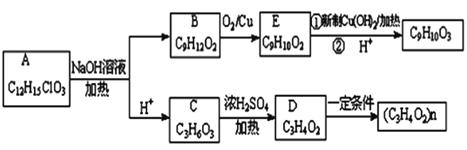
已知:D能使溴的CCl4溶液褪色;B不能与FeCl3溶液发生显色反应,1molB最多能与2mol金属钠反应;C的催化氧化产物不能发生银镜反应。请回答下列问题:
(1)写出E中含氧官能团的名称____________。
(2)写出A的可能的一种结构简式___________。
(3)写出反应类型:C→D_________;B→E__________。
(4)写出E与新制Cu(OH)2反应的化学方程式_____________。
(5)E有多种同分异构体,满足下列条件的同分异构体有_______种,写出其中任意一种同分异构体的结构简式____________。(任写一种)
①含有苯环且苯环上只有一个取代基 ②分子结构中含有甲基 ③能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制备乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
(实验目的) 制取乙酸乙酯
(1).(实验原理) 甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸作吸水剂和__________。
(2).(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:
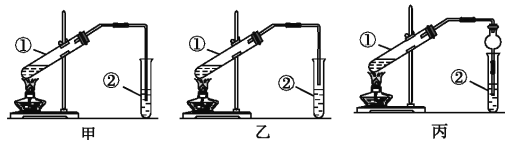
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是______(填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是__________。
(实验步骤)
①按你选择的装置组装仪器,在试管中先加入3mL乙醇,然后边振荡试管①边慢慢加入2mL浓H2SO4和2mL乙酸;
②将试管①固定在铁架上;
③在试管②中加入适量的饱和Na2CO3溶液;
④用酒精灯对试管①缓慢加热;
⑤当观察到试管②中有明显现象时停止实验。
(3).(问题讨论)
a.步骤(1)装好实验装置,加入样品前还应检查__________;
b.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:无色油状液体、__________;
c.试管②中分离出乙酸乙酯的实验操作是__________。
d.写出制备乙酸乙酯的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述错误的是( )
A. 离子晶体中,一定存在离子键
B. 原子晶体中,只存在共价键
C. 金属晶体的熔、沸点均很高
D. 稀有气体的原子能形成分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。
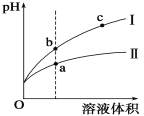
据图判断正确的是
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点酸的总浓度大于a点酸的总浓度
C.a点Kw的数值比c点Kw的数值大
D.b点溶液的导电性比c点溶液的导电性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)依据氧化还原反应2Ag+(ag)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
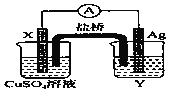
电极X的材料是_______;电解质溶液Y是_________________;银电极为电池的________极,发生的电极反应为______________________;X电极上发生的电极反应为______________________。
(2)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入CH4和O2,该电池即为氢氧燃料电池,
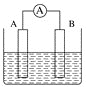
写出A电极反应式:___________________________________;写出B电极反应式:_______________________;写出该电池反应:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1L,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是__________,一定存在的阳离子是___________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______,所得沉淀的最大质量是______g。
(4)若通过实验确定原废水中c(Na+)=0.18 mol·L-1,试判断原废水中NO3-是否存在?____(填“存在”“不存在”或“不确定”)。若存在, c(NO3-) = _____ mol·L-1。(若不存在或不确定则此空不填)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com