
����Ŀ��ȫ��̬����������ܶȸߡ��ɱ��ͣ��乤��ԭ����ͼ��ʾ�����е缫a���ò���ʯīϩ��S8���ϣ���ط�ӦΪ��16Li+xS8=8Li2Sx��2��x��8��������˵��������ǣ�������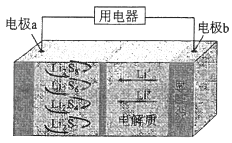
A.��ع���ʱ�������ɷ�����Ӧ��2Li2S6+2Li++2e��=3Li2S4
B.��ع���ʱ�����·������0.02 mol���ӣ��������ϼ���0.14 g
C.ʯīϩ��������Ҫ����ߵ缫a�ĵ�����
D.��س��ʱ��Խ��������е�Li2S2��Խ��
���𰸡�D
���������⣺A���ݷ�����֪�����ɷ�����Ӧ��2Li2S6+2Li++2e��=3Li2S4 �� ��A��ȷ��
B��������ӦΪ��Li��e��=Li+ �� �����·����0.02mol����ʱ�����ĵ��Ϊ0.02mol���������ص�����Ϊ0.02mol��7g/mol=0.14g����B��ȷ��
C������Ϊ����������ʣ������Էdz����ʯīϩ�������������µ�����õIJ��ϣ���ʯīϩ��������Ҫ����ߵ缫a�ĵ����ԣ���C��ȷ��
D�����ʱaΪ��������ŵ�ʱ�ĵ缫��Ӧ�෴������ʱ��Խ��������е�Li2S2���ͻ�Խ�٣���D����
��ѡD��
�ɵ�ط�Ӧ16Li+xS8=8Li2Sx��2��x��8����֪�����ʧ���ӷ���������Ӧ���缫��ӦΪ��Li��e��=Li+ �� Li+��������������a��������������ԭ��Ӧ��S8+2e��=S82�� �� S82��+2Li+=Li2S8 �� 3Li2S8+2Li++2e��=4Li2S6 �� 2Li2S6+2Li++2e��=3Li2S4 �� Li2S4+2Li++2e��=2Li2S2 �� ���ݵ缫��Ӧʽ��ϵ���ת�ƽ��м��㣮


 һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ����Ҫ�ɷ���Cu2S����ұ��ͭ����Ҫԭ�ϣ���ͭ����Ʒ�Ĵ��ȿ��������Ը��������Һ�ζ����ⶨ���÷�Ӧ�ɱ�ʾΪCu2S+ ![]() +H+��Cu2++
+H+��Cu2++ ![]() +Mn2++H2O��δ��ƽ��������˵���в���ȷ���ǣ� ��
+Mn2++H2O��δ��ƽ��������˵���в���ȷ���ǣ� ��
A.Cu2SΪ��ԭ���������� ![]() Ϊ����������ԭ
Ϊ����������ԭ
B.�������ͻ�ԭ�����ʵ���֮��Ϊ2��1
C.��Ӧ��ÿ����1 mol Cu2S��ת��8 mol����
D.�ζ�ʱ���Բ���������ָʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Һ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��Na2S2O3+H2SO4�TNa2SO4+SO2��+S��+H2O�����и���ʵ�������ȳ��ֻ��ǵ��ǣ� ��
ʵ�� | ��Ӧ�¶�/�� | Na2S2O3��Һ | ϡH2S4 | H2O | ||
V/mL | c��molL��1�� | V/mL | c��molL��1�� | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��I2��ˮ���ܽ�Ⱥ�С����KI��Һ���ܽ���������� I2��KI��Һ�д�������ƽ�⣺I2��aq��+I����aq��I3����aq������ò�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ����ͼ��ʾ������˵����ȷ���ǣ� �� 
A.��ӦI2��aq��+I����aq��I3����aq���ġ�H��0
B.���ø÷�Ӧ���Գ�ȥ����������ĵⵥ��
C.������ƽ����ϵ�м��뱽��ƽ�ⲻ�ƶ�
D.25��ʱ��������ƽ����ϵ�м�������KI���壬ƽ�ⳣ��KС��680
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣��û�ѧ����ش��������⣺
���� ���ڡ� | ��A | ��A | ��A | ��A | ��A | ��A | ��A |
1 | �� | ||||||
2 | �� | �� | �� | ||||
3 | �� | �� | �� | �� | �� | �� |
��1�����ԭ�ӽṹʾ��ͼΪ________________________________��
��2���ں͢���̬�⻯���ȶ��ԵĴ�С˳��___________(�ѧʽ)��
��3���ۢ�����ۺ������������ǿ����__________(�ѧʽ)��
��4���۵���̬�⻯����۵�����������Ӧ��ˮ���ﷴӦ���ɵ�����________(�ѧʽ)��������________(�������ۻ��������������ӻ�������)��
��5���٢ܢ�����Ԫ�ص�ԭ�����γ�ԭ����Ŀ��Ϊ1��1��1�Ĺ��ۻ�������ĵ���ʽΪ________��
��6�����ȽϢܺ͢�����Ԫ�صķǽ�����ǿ����������Ϊ��֤��֤����________(����ĸ)��
A���Ƚ�������Ԫ�ص��ʵķе�
B���Ƚ�������Ԫ�ص������������ϵ�����
C���Ƚ�������Ԫ�ص�����������Ӧˮ����������
D���Ƚ�������Ԫ�ص��������Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�С����������װ�ã��Ʊ�LiH���塣
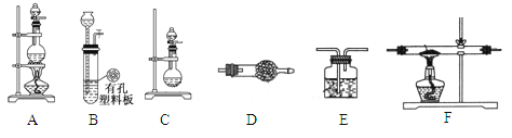
��1��Ԫ��������ڱ��е�λ�� __________________��
��2����LiH�����бȽ����Ӱ뾶��С��ϵr(Li+) _________r(H-)��(����>������<��)
��3���С����������������װ���Ʊ�LiH���塣��ѡ�õ�ҩƷ�У�����ﮡ�п����ϡ���ᡢŨ���ᡢ��ʯ�ҡ���֪���⻯ﮣ�LiH���ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�ա����ʵ�鷽�����£�
������װ������˳��ΪB��D��F��E������ҩƷǰ����Ҫ���е�ʵ�������___________________������д������IJ���������������ҩƷ������װ��D��������____________________________��
��ͨ��һ��ʱ�����������ʯӢ�ܣ��ڼ���F����ʯӢ��֮ǰ��������е�ʵ�������_______________________________��
�ۼ���һ��ʱ���ֹͣ���ȣ�����ͨ������ȴ��Ȼ��ȡ��LiH��װ�뵪���ƿ������ڰ�������ȡ����������Ŀ����Ϊ�˱���LiH������е�ˮ�����Ӵ�������Σ�ա����LiH��ˮ��Ӧ�Ļ�ѧ����ʽ___________________________________��
��ȷ�����ƵõIJ�Ʒ0.11g����һ��������������ˮ��Ӧ���ռ�������291.2 mL���ѻ���ɱ�״���������Ʒ��LiH��Li�����ʵ���֮��Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����12�֣�����Ӧ�ù㷺�Ľ���������������Ҫ�ɷ�ΪAl2O3 �� ��SiO2��Fe2O3�����ʣ�Ϊԭ���Ʊ�����һ�ֹ����������£�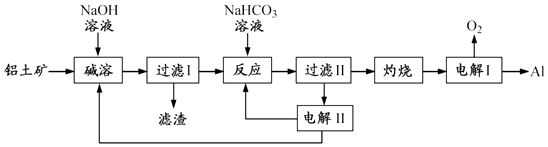
ע��SiO2�ڡ����ܡ�ʱת��Ϊ�������Ƴ�����
��1�������ܡ�ʱ����ƫ�����Ƶ����ӷ���ʽΪ ��
��2�����ˢ�������Һ�м���NaHCO3��Һ����Һ��pH ������������䡱��С������
��3���������ǵ������ Al2O3 �� ����������������ʯī�����ģ�ԭ���� ��
��4���������ǵ��Na2CO3��Һ��ԭ����ͼ��ʾ��
�����ĵ缫��ӦʽΪ �� ��������������A�Ļ�ѧʽΪ ��
��5��������1000��ʱ����N2��Ӧ�Ʊ�AlN������������������NH4Cl���岢��ֻ�ϣ�������AlN���Ʊ�������Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15�֣��ظ������һ����Ҫ�Ļ���ԭ�ϣ�һ���ɸ������Ʊ������������Ҫ�ɷ�ΪFeOCr2O3 �� �����й衢�������ʣ��Ʊ�������ͼ��ʾ��
�ش��������⣺
��1������ٵ���Ҫ��ӦΪ��FeOCr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+Fe2O3+CO2+NaNO2������Ӧ��ƽ��FeOCr2O3��NaNO3��ϵ����Ϊ �� �ò��費��ʹ���մ�������ԭ���� ��
Na2CrO4+Fe2O3+CO2+NaNO2������Ӧ��ƽ��FeOCr2O3��NaNO3��ϵ����Ϊ �� �ò��費��ʹ���մ�������ԭ���� ��
��2������1�к������Ľ���Ԫ���� �� ����2����Ҫ�ɷ������������ʣ�
��3������ܵ���Һ2��pHʹ֮�������С������ԭ�����������ӷ���ʽ��ʾ����
��4���й����ʵ��ܽ����ͼ��ʾ��
����Һ3���м�������KCl������Ũ������ȴ�ᾧ�����˵õ�K2Cr2O7���壮��ȴ�������ţ��õ���K2Cr2O7�����Ʒ��࣮
a.80�� b.60�� c.40�� d.10��
����ݵķ�Ӧ������ ��
��5��ij������m1 kg ������ۣ���Cr2O3 40%���Ʊ�K2Cr2O7 �� ���յõ���Ʒ m2 kg������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�á�������������ȷ����
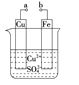
A��a��b������ʱ����Ƭ�ϻ��н���ͭ����
B��a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪ��Cu2����2e��===Cu
C������a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ������ɫ���dz��ɫ
D��a��b����ʱ��ͭƬ�Ϸ���������Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com