
【题目】(写出计算步骤)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g),△H>0请回答下列问题:
P(g)+Q(g),△H>0请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol·L-1,c(N)=2.4mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为多少______?平衡常数?__
(2)若反应温度不变,反应物的起始浓度分别为:c(M)=4mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2mol·L-1,a=?;________
(3)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=bmolL-1,,达到平衡后,M的转化率为多少?________
科目:高中化学 来源: 题型:
【题目】根据下列两个热化学方程式,回答下列问题:
2H2(g)+O2(g)![]() 2H2O(1) ΔH=571.6 kJ · mol1
2H2O(1) ΔH=571.6 kJ · mol1
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
(1)H2的燃烧热为_______,C3H8的燃烧热为_______。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为______________。
(3)现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇的结构简式为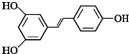 。根据要求回答下列问题:
。根据要求回答下列问题:
(1)白藜芦醇的分子式为 _______________
(2)所含官能团的名称为____________
(3)下列关于白藜芦醇的分类判断正确的是_________
A.它属于链状烯烃 B.它属于脂环化合物
C.它属于芳香化合物 D.它属于烃的衍生物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法错误的是( )
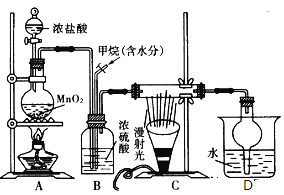
A. 实验时先点燃A处酒精灯再通甲烷
B. 装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C. 装置C经过一段时间的强光照射后,生成的有机物有4种
D. 从D中分离出盐酸的方法为过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A充分燃烧消耗氧气的量不相等的是(填序号)_______。
A. C7H12O2 B.C6H14 C.C6H14O D. C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则A的结构简式为_____________。
(3)若链烃A的分子结构中有三种氢原子,个数比为3:2:1,则A的名称为________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[双选题]铝-空气原电池通常以![]() 溶液或
溶液或![]() 溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法不正确的是( )
溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法不正确的是( )
A.以![]() 溶液或
溶液或![]() 溶液为电解质溶液时,正极的电极反应均为
溶液为电解质溶液时,正极的电极反应均为![]()
B.以溶液为电解质溶液时,负极的电极反应为![]()
C.以![]() 溶液为电解质溶液时,负极的电极反应为
溶液为电解质溶液时,负极的电极反应为![]()
D.以![]() 溶液为电解质溶液时,负极的电极反应
溶液为电解质溶液时,负极的电极反应![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y 和 Z 三种元素的原子序数之和等于 42。X 元素原子的 4p 轨道上有 3 个未成 对电子,Y 元素原子的最外层 2p 轨道上有 2 个未成对电子。X 跟 Y 可形成化合物 X2Y3, Z 元素可以形成负一价离子,下列说法正确的是
A.X 元素原子基态时的电子排布式为[Ar]4s24p3
B.X 元素是第四周期第ⅤA 族元素
C.Y 元素原子的电子排布图为![]()
D.Z 元素的氧化物具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地以高硫铝土矿![]() 主要含Al2O3、Fe2O3、SiO2和少量的FeS2等
主要含Al2O3、Fe2O3、SiO2和少量的FeS2等![]() 提取氧化铝和磁性氧化铁,直接碱溶法往往形成铝硅酸钠沉淀[NamAlmSinO16(OH)5]而造成铝损失。一种改进后的流程如下:
提取氧化铝和磁性氧化铁,直接碱溶法往往形成铝硅酸钠沉淀[NamAlmSinO16(OH)5]而造成铝损失。一种改进后的流程如下:
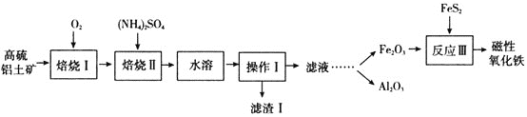
⑴铁在元素周期表中的位置是________________;NamAlmSinO16(OH)5中的m和n之间满足什么样的代数式________;写出滤渣Ⅰ主要成分的一种用途:________________________;反应Ⅲ加入FeS2的目的是作为________________________![]() 填“氧化剂”或“还原剂”
填“氧化剂”或“还原剂”![]() 。
。
⑵焙烧Ⅰ过程中会产生大量红棕色烟尘和SO2气体,写出产生这一现象的化学方程式:________________________________________________。
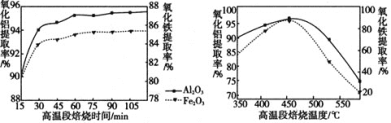
⑶焙烧Ⅱ由氧化铝、氧化铁制得可溶性的NH4Al(SO4)2、NH4Fe(SO4)2。提取率随温度、时间变化曲线如图所示,最佳的焙烧时间与温度是________________。若以NH4R(SO4)2表示NH4Al(SO4)2、NH4Fe(SO4)2,相关的化学反应方程式为________________________。
⑷下列有关铝硅酸钠[NamAlmSinO16(OH)5]中所含元素性质的说法正确的是________。
A.因为原子半径:Na > S,所以离子半径:Na+ > S2-
B.因为非金属性:S > Si,所以简单气态氢化物稳定性:SiH4 < H2S
C.因为非金属性:O > S,所以沸点; H2S > H2O
D.因为金属性:Na > Al,所以碱性:NaOH > Al(OH)3
⑸为了测定Wg高硫铝土矿中铝元素的含量,将流程中制取的Al2O3溶解于足量稀硫酸,配成250mL溶液,取出25mL,加入c mol·L-1 EDTA标准溶液amL,调节溶液pH约为4.2,煮沸,冷却后用b mol·L-1 CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液V mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1:1)。则Wg高硫铝土矿中铝元素的质量分数为________________________![]() 用含V、W、a、b、c的代数式表示
用含V、W、a、b、c的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铁、砷、硒、锌等元素的单质及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为_______,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有________种。
(2)铁的第三电离能![]() 、第四电离能
、第四电离能![]() 分别为
分别为![]() 和
和![]() ,
,![]() 远大于
远大于![]() 的原因是______________________。
的原因是______________________。
(3)![]() 离子可用于
离子可用于![]() 的检验,其对应的酸有两种,分别为硫氰酸
的检验,其对应的酸有两种,分别为硫氰酸![]() 和异硫氰酸
和异硫氰酸![]() 。
。
①写出与![]() 互为等电子体的一种微粒_________
互为等电子体的一种微粒_________![]() 分子或离子
分子或离子![]() ;
;
②异硫氰酸的沸点比硫氰酸沸点高的原因是_______________。
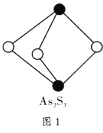
(4)成语“信口雌黄”中的雌黄分子式为![]() ,分子结构如图1所示,As原子的杂化方式为_______________。
,分子结构如图1所示,As原子的杂化方式为_______________。
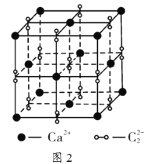
(5)离子化合物![]() 的晶胞结构如图2所示。一个晶胞含有的
的晶胞结构如图2所示。一个晶胞含有的![]() 键有__________个。
键有__________个。
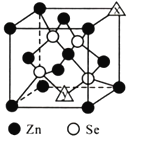
(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为____________![]() 填元素符号
填元素符号![]() ;该晶胞中硒原子所处空隙类型为____________
;该晶胞中硒原子所处空隙类型为____________![]() 填“立方体”、“正四面体”或“正八面体”
填“立方体”、“正四面体”或“正八面体”![]() ,该种空隙的填充率为____________;若该晶胞密度为
,该种空隙的填充率为____________;若该晶胞密度为![]() ,硒化锌的摩尔质量为
,硒化锌的摩尔质量为![]() 。用
。用![]() 代表阿伏加德罗常数的数值,则晶胞参数a为____________nm。
代表阿伏加德罗常数的数值,则晶胞参数a为____________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com