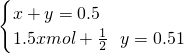解:(1)铜和稀硝酸反应的方程式为:3Cu+8HNO
3=3Cu(NO
3 )
2+2NO↑+4H
2O,
故答案为:3Cu+8HNO
3=3Cu(NO
3 )
2+2NO↑+4H
2O;
(2)铜离子浓度大时,溶液呈绿色,所以观察到溶液呈绿色;一氧化氮气体是无色气体,且不溶于水,所以观察到收集的气体是无色的.
故答案为:绿色;无色;
(3)一氧化氮不稳定,和空气中的氧气在容器的上部反应生成红棕色的二氧化氮气体,反应方程式为2NO+O
2=2NO
2.
故答案为:在铜和稀硝酸反应容器的上部看到了红棕色气体;2NO+O
2=2NO
2;
(4)2、铜离子浓度大时,溶液呈绿色,所以观察到溶液呈绿色;一氧化氮气体是无色气体,且不溶于水,所以观察到收集的气体是无色的.
3、一氧化氮不稳定,和空气中的氧气反应生成红棕色的二氧化氮气体,所以在与空气接触后立即变成红棕色.
故答案为:有无色气体产生,右边溶液逐渐变成绿色;无色气体与空气接触后立即变成红棕色;
(5)一氧化氮、二氧化氮都是有毒的气体,不能直接排空,污染大气,故答案为:将氮氧化合物放入空气中会污染环境;
(6)无色气体与空气接触后立即变成红棕色,所以与第3步相同;利用外界大气压把溶液压入试管中,所以要打开分液漏斗上部的塞子;使分液漏斗内的溶液进入试管,还要慢慢打开分液漏斗的活塞;防止生成的一氧化氮污染大气,所以待液面与胶塞接触时立即关闭活塞.
故答案为:3;打开分液漏斗上部的塞子;慢慢打开分液漏斗的活塞;待液面与胶塞接触时立即关闭活塞;
(7)二氧化氮和水反应生成硝酸和一氧化氮,3NO
2+H
2O=2HNO
3+NO,故答案为:3NO
2+H
2O=2HNO
3+NO;
(8)①无论一氧化氮还是二氧化氮,一个分子中都含有一个氮原子,一个硝酸分子中含有一个氮原子,所以气体的物质的量与参加氧化还原反应的硝酸的物质的量相等.
HNO
3--NOx
1mol 22.4L
0.5mol 11.2L
所以参加氧化还原反应硝酸的物质的量为 0.5mol.
起酸作用硝酸的物质的量为:
3Cu--6HNO
3--3Cu(NO
3 )
2
3mol 6mol
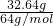
1.02mol
所以起酸作用硝酸的物质的量为:1.02mol,故参加反应的硝酸的物质的量为 0.5mol+1.02mol=1.52mol
所以硝酸的浓度为
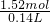
=10.86mol﹒L
-1
故答案为:10.86mol﹒L
-1;
②通过①知,生成气体消耗的硝酸的物质的量为0.5mol
向溶液中加入VmL amol?L
-1的NaOH溶液,恰好使溶液中的Cu
2+全部转化为沉淀时,未参加氧化还原反应的硝酸根离子全部转化为硝酸钠中的硝酸根离子,根据原子守恒,硝酸、硝酸根离子、硝酸钠、氢氧化钠之间的关系式
HNO
3--NO
3---NaNO
3--NaOH
1mol 1mol
10
-3a﹒Vmol 10
-3a﹒Vmol
所以为参加氧化还原反应的硝酸的物质的量为10
-3a﹒Vmol
所以反应的硝酸的物质的量为10
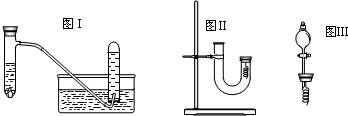
-3a﹒Vmol+0.5mol
所以原硝酸的浓度为
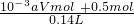
=
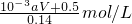
故答案为:
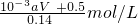
;
③设生成的一氧化氮为xmol,二氧化氮为ymol.
3Cu+8HNO
3=3Cu(NO
3 )
2+2NO↑+4H
2O
3 2
1.5xmol xmol
Cu+4HNO
3(浓)=Cu(NO
3 )
2+2NO
2↑+2H
2O
1 2

ymol.ymol.
所以方程组为
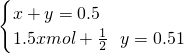
所以
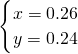
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H
2O+3O
2=4HNO
3
4 3
0.26mol 0.195mol
4 NO
2+2H
2O+O
2=4HNO
34 1
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L,
故答案为:5.71.
分析:(1)根据铜与稀硝酸的反应写出相应的反应方程式;
(2)根据铜离子、一氧化氮的颜色分析;
(3)根据观察到的现象确定并写出反应方程式;
(4)根据生成物的颜色推断现象;根据一氧化氮的性质推断现象;
(5)根据氮氧化物的性质分析;
(6)①根据氮原子守恒用气体的物质的量计算硝酸的物质的量;
②根据生成的气体计算参加氧化还原反应的硝酸,根据氢氧化钠计算未参加氧化还原反应的硝酸,这两部分硝酸即为参加反应的硝酸,然后根据浓度公式计算.
③根据铜和气体的量列方程组计算生成的一氧化氮、二氧化氮的物质的量,再根据一氧化氮、二氧化氮与氧气反应的关系计算氧气的体积.
点评:本题以硝酸的性质为载体考查了氧化还原反应的有关计算,本题计算量较大,所以计算时要认真、仔细,否则容易出错;要注意反应中部分硝酸参加氧化还原反应,运用原子守恒的解题方法较方便.


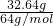 1.02mol
1.02mol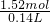 =10.86mol﹒L-1
=10.86mol﹒L-1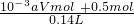 =
=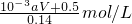
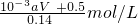 ;
; ymol.ymol.
ymol.ymol.