
| A. | ①③ | B. | ③④ | C. | ①④ | D. | ②③ |
分析 ①中Na与FeCl2溶液反应生成Fe(OH)2沉淀和H2;
②中过量的NaOH溶液和KAl(SO4)2溶液反应,一方面使Al3+变为AlO2-,即无沉淀产生,另一方面也无气体生成;
③中CaO与NaHCO3溶液反应生成CaCO3沉淀;
④中Na2O2与CuSO4溶液反应生成Cu(OH)2沉淀和O2;
解答 解:①钠浮在水面上,与水剧烈反应,并放出大量热,熔化成小球,黄色的溶液变成红色沉淀,发生2Na+H2O=2NaOH+H2↑、3NaOH+FeCl3=3NaCl+Fe(OH)3↓,故①既有气体生成最终又有沉淀生成;
②过量的NaOH溶液和明矾溶液反应的方程式为:KAl(SO4)2•12H2O+4NaOH=KAlO2+14H2O+2Na2SO4,故②中既无气体生成最终又无沉淀生成;
③中CaO与NaHCO3溶液反应生成CaCO3沉淀;,故③最终只有沉淀生成;
④Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,NaOH与CuSO4发生反应:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,故④中既有气体生成最终又有沉淀生成;
故选C.
点评 该题主要考查了元素钠、铝、硫、铁的化合物的性质,要求掌握这些化合物的一些重要的化学反应方程式,并理解为什么会发生,从而运用这些反应解相关的问题.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
| A. | Q3>Q2>Q1 | B. | Q1>Q3>Q2 | C. | Q1=Q2=Q3 | D. | Q2>Q3>Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
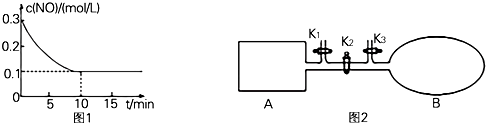
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e-=4OH- | |
| B. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
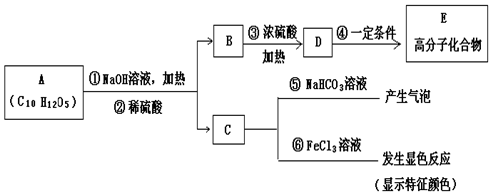
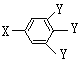 (其中:-X、-Y均为官能团
(其中:-X、-Y均为官能团 .
.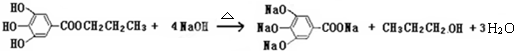
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C是还原剂 | |
| B. | TiO2是氧化剂 | |
| C. | 生成1 mol TiCl4时,转移电子4 mol | |
| D. | 尾气必须净化处理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com