
 T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.
T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.| 1 |
| 2 |
| 3 |
| 2 |
| 0.5mol/L |
| 1mol/L |
| (1mol/L) 2 |
| (0.5mol/L)?(0.5mol/L) 3 |
| 2mol |
| 2L |
| 2mol |
| 2L |
| (2mol/L)2 |
| 1.5mol/L?(0.5mol/L) 3 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
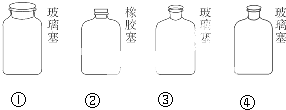
| A、①②③④ | B、②①④③ |
| C、②③④① | D、②①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应前物质质量/g | 反应后物质质量/g | |
| Cu-Zn合金 | 稀硫酸 | 滤液质量 |
| 4.0 | 10 | 11.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
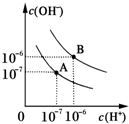 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 金属(大小、形状相同的粉末)物质的量 | 酸的浓度及体积 | 反应温度/℃ |
| A | Mg 0.1 mol | 3 mol?L-1的硝酸10 mL | 60 |
| B | Mg 0.1 mol | 3 mol?L-1的盐酸10 mL | 30 |
| C | Fe 0.1 mol | 3 mol?L-1的盐酸10 mL | 60 |
| D | Mg 0.1 mol | 3 mol?L-1的盐酸10 mL | 60 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| B、C(石墨,s)═C(金刚石,s)△H>0,所以金刚石比石墨稳定 |
| C、已知碳的燃烧热为ykJ/mol,当7.2g的碳在12.8g的氧气中燃烧,至反应物耗尽并放出xkJ的热量,则可求出1mol碳与氧气反应生成1mol一氧化碳气体时△H=-(2.5x-0.5y)kJ/mol |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、290 | B、282 |
| C、280 | D、278 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com