
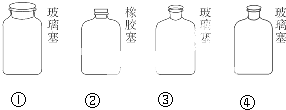
| A、①②③④ | B、②①④③ |
| C、②③④① | D、②①③④ |
科目:高中化学 来源: 题型:

| 金属离子 | 开始沉淀时溶液pH | 完全沉淀时溶液pH |
| Zn2+ | 5.4 | 6.4 |
| Fe2+ | 6.5 | 7.5 |
| Cu2+ | 4.2 | 6.7 |
| Co2+ | 6.6 | 7.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液混合,所得溶液中一定存在:c (K+)+c (H+)=c (CH3COO-)+c (OH-) |
| B、氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C、把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c (OH-)>c (Ba2+)>c (Na+)>c (H+) |
| D、常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减小 | B、增大 |
| C、不变 | D、可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.
T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com