
【题目】用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000 mL溶液。除了烧杯外,还需要的玻璃仪器有_____________ 、____________、和_____________。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_______________式滴定管。
②滴定时眼睛应________.
③有关数据记录如下:
测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.50 |
2 | 20.00 | 1.20 | 21.20 |
(3)计算纯度:烧碱样品的纯度是_______。
(4)误差分析(填“偏高”,“偏低”,或“无影响”)
a. 酸式滴定管用蒸馏水洗后未用标准液润洗,就直接装入标准液,造成测定结果____________。
b、锥形瓶水洗后,又用待测液润洗,,测定结果____________。
c、用碱式滴定管取待测液时,滴定管尖嘴处有气泡未排出就取液入锥形瓶,造成测定结果____________。
d、滴定前,锥形瓶用水洗涤后,锥形瓶中残留水未干燥,造成最终结果___。
e、酸式滴定管,滴定前仰视读数,滴定后平视读数,造成测定结果__________。
【答案】1 000 mL容量瓶 胶头滴管 玻璃棒 酸 注视锥形瓶中溶液颜色的变化 80.% 偏高 偏高 偏低 无影响 偏低
【解析】
用中和滴定法测定某烧碱样品的纯度时,反应原理为HCl+NaOH=NaCl+H2O,实验步骤为配制待测液→滴定→计算→误差分析,需要的实验仪器有一定规格的容量瓶、烧杯、滴定管、托盘天平、胶头滴管、玻璃棒、锥形瓶,计算和误差分析时,根据公式![]() ,
,![]() 进行分析解答。
进行分析解答。
(1)配制1000mL待测液时,需要用到的玻璃仪器有烧杯、玻璃杯、胶头滴管、1000mL的容量瓶,故答案为:1000mL的容量瓶、胶头滴管、玻璃杯;
(2)①盐酸标准液为酸性溶液,应使用酸式滴定管盛装,故答案为:酸;
②滴定时,左手控制滴定管的活塞,右手不停的向同一方向摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,故答案为:注视锥形瓶中溶液颜色的变化;
(3)根据表格数据可知,消耗盐酸的平均体积为![]() ,则20mL待测液中NaOH的物质的量为n(NaOH)=c(NaOH)·V(NaOH)=c(HCl)·V(HCl)=0.1000mol·L-1×0.02L=0.002mol,则样品中m(NaOH)=n(NaOH)·M(NaOH)=(0.002×50)mol×40g/mol=4g,因此烧碱样品的纯度为
,则20mL待测液中NaOH的物质的量为n(NaOH)=c(NaOH)·V(NaOH)=c(HCl)·V(HCl)=0.1000mol·L-1×0.02L=0.002mol,则样品中m(NaOH)=n(NaOH)·M(NaOH)=(0.002×50)mol×40g/mol=4g,因此烧碱样品的纯度为![]() ,故答案为80%;
,故答案为80%;
(4)a.酸式滴定管用蒸馏水洗后未用标准液润洗,直接装入标准液会是盐酸标准液浓度降低,消耗的盐酸标准液体积变大,从而使得计算出NaOH的质量偏大,造成测定结果偏高,故答案为:偏高;
b.锥形瓶水洗后,又用待测液润洗,导致待测液含量变大,消耗的盐酸标准液体积变大,从而使得计算出NaOH的质量偏大,造成测定结果偏高,故答案为:偏高;
c.用碱式滴定管取待测液时,滴定管尖嘴处有气泡未排出就取液入锥形瓶,取得的待测液减小,则消耗的盐酸标准液体积变小,从而使得计算出NaOH的质量偏小,造成测定结果偏低,故答案为:偏低;
d.滴定前,锥形瓶用水洗涤后,锥形瓶中残留水未干燥,对实验结果没有影响,故答案为:无影响;
e.酸式滴定管,滴定前仰视读数,滴定后平视读数,读得消耗的盐酸标准液体积变小,从而使得计算出NaOH的质量偏小,造成测定结果偏低,故答案为:偏低。


科目:高中化学 来源: 题型:
【题目】某实验小组将废铁屑(含硫化亚铁等杂质)和稀硫酸加入锥形瓶中,加热,充分反应,冷却后加入氨水,制得硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O],装置如下图(夹持仪器略去)。下列说法或操作错误的是
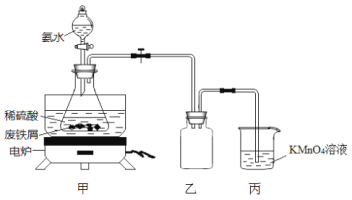
A.乙装置是安全瓶
B.将氨水滴入时,先缓慢打开活塞,再打开玻璃塞
C.KMnO4溶液的作用是吸收H2S等尾气,防止污染空气
D.锥形瓶中发生中和反应的离子方程式:NH3·H2O+H+=NH4++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下浓度均为![]() 的下列5种溶液:
的下列5种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
![]() 这5种溶液pH由大到小的顺序是________________,其中由水电离的
这5种溶液pH由大到小的顺序是________________,其中由水电离的![]() 浓度最小的是______。
浓度最小的是______。![]() 填序号
填序号![]()
![]() 中各离子浓度由大到小的顺序是________________________________________________________,
中各离子浓度由大到小的顺序是________________________________________________________,![]() 的水解平衡常数
的水解平衡常数![]() _________________。
_________________。![]() 已知碳酸的电离常数
已知碳酸的电离常数![]() ,
,![]()
![]() 向
向![]() 中通入少量氨气,此时
中通入少量氨气,此时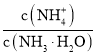 的值__________
的值__________![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 若将
若将![]() 和
和![]() 混合后溶液恰好呈中性,则混合前
混合后溶液恰好呈中性,则混合前![]() 的体积______
的体积______![]() 的体积
的体积![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 。
。
![]() 将
将![]() 的溶液分别蒸干并灼烧,最终可得原溶质的是____________
的溶液分别蒸干并灼烧,最终可得原溶质的是____________![]() 填序号
填序号![]() 。
。
![]() 一定量的稀
一定量的稀![]() 溶液与足量的Zn反应,为减缓产生的
溶液与足量的Zn反应,为减缓产生的![]() 速率但又不影响
速率但又不影响![]() 的总量,可采取的措施是______
的总量,可采取的措施是______![]() 填字母
填字母![]() 。
。
A.加![]() 固体
固体![]() 加
加![]() 固体
固体![]() 加
加![]() 溶液
溶液![]() 加氨水
加氨水![]() 加
加![]() 溶液
溶液
![]() 常温下,向
常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为_____
的溶液为_____![]()
![]() 已知常温下
已知常温下![]() 。
。
![]() 等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中
等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸等体积混合后溶液呈__________________性,溶液中
的醋酸等体积混合后溶液呈__________________性,溶液中![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
![]() 常温下,用
常温下,用![]() 溶液滴定
溶液滴定![]() 某一元酸HA溶液所得滴定曲线如图.
某一元酸HA溶液所得滴定曲线如图.
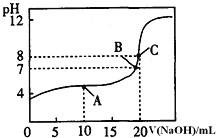
![]() A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
![]() 点的离子浓度大小关系是 ________________________________ .
点的离子浓度大小关系是 ________________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )

A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)提纯下列物质(括号内为杂质),填写所选用的除杂试剂和除杂方法
括号内为杂质 | 除杂试剂 | 操作 | |
1 | 乙烷(乙烯) | _____ | _____ |
2 | 乙酸乙酯(乙酸) | _____ | _____ |
3 | 苯(苯酚) | _____ | _____ |
4 | 乙醇(水) | _____ | _____ |
(2)以五倍子为原料可制得A,A结构简式如图所示,回答下列问题:
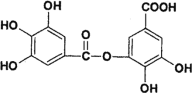
①A的分子式为_______________。
②有机化合物B在硫酸催化条件下加热发生酯化可得到A。写出B的结构简式为____________。
③写出A与过量NaOH溶液反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是 ( )
A.使用医用酒精杀菌消毒的过程中只发生了物理变化
B.医用口罩无纺布的原材料成分之一是聚丙烯,其结构简式为![]()
C.疫苗一般应冷藏存放,以避免蛋白质变性
D.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铁是中学化学常见的金属。请回答下列问题:
(1)常温下,铝和铁放入浓HNO3中会发生_______;
A.都反应产生氢气B.只有铝反应产生氢气
C.只有铁反应产生氢气D.都钝化
(2)常温下,铝粉和铁粉分别放入氢氧化钠溶液中,能反应产生氢气的是_______,
(3)铝热反应的化学方程式:2Al+Fe2O3![]() 2Fe+Al2O3,其氧化剂是_________。
2Fe+Al2O3,其氧化剂是_________。
A.AlB.FeC.Fe2O3D.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硝酸铵的流程如下图所示:
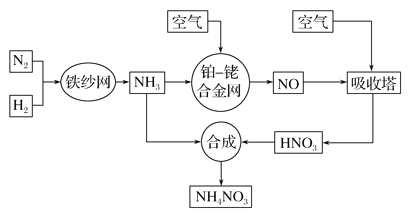
请回答下列问题:
(1)已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1。
2NH3(g) ΔH=-92.4 kJ· mol-1。
①在500 ℃、2.02×107 Pa和铁催化条件下向一密闭容器中充入1 mol N2和3 mol H2,充分反应后,放出的热量________(填“大于”、“小于”或“等于”)92.4 kJ。
②为提高H2的转化率,实际生产中宜采取的措施有________(填字母)。
A.降低温度
B.最适合催化剂活性的适当高温
C.适当增大压强
D.减小压强
E.循环利用和不断补充氮气
F.及时移出氨
(2)该流程中铂—铑合金网上的氧化还原反应为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。
4NO(g)+6H2O(g)。
①已知铂—铑合金网未预热也会发热,则随着温度升高,该反应的化学平衡常数K________(填“增大”、“减小”或“不变”),理由是__________________________________________________________________。
②若其他条件不变,则下列图像正确的是________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;
O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;
CO(g)+![]() O2(g)=CO2(g)△H=-283.0kJmol-1;
O2(g)=CO2(g)△H=-283.0kJmol-1;
H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1;
O2(g)=H2O(l)△H=-285.8kJmol-1;
则CO(g)+2H2(g)![]() CH3OH(g)△H=___________kJmol-1.
CH3OH(g)△H=___________kJmol-1.
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___________(填写序号).
a.使用催化剂;b.降低反应温度;
c.增大体系压强;d.不断将CH3OH从反应混合物中分离出来;
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示.
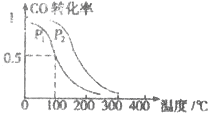
①P1___________P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=___________;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、 H2、CH3OH各0.5amol,则平衡___________(填“向左”“不”或“想右”)移动
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___________;
(5)CaSO3溶液与CaC12溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___________。用CaSO3溶液充分吸收SO2得NaHSO2溶液,然后电解该溶液,电解原理示意图如下图所示。请写出该电解池发生反应的化学方程式___________。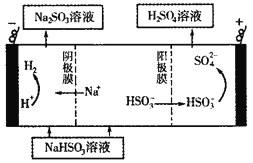
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com