
【题目】化学与生产、生活密切相关。下列说法错误的是 ( )
A.使用医用酒精杀菌消毒的过程中只发生了物理变化
B.医用口罩无纺布的原材料成分之一是聚丙烯,其结构简式为![]()
C.疫苗一般应冷藏存放,以避免蛋白质变性
D.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O
请根据要求填写下列空白:
(1)溶液①呈_________性(填“酸”、“碱”或“中”),其原因是_____________(用离子方程式表示)。
(2)在上述五种溶液中,pH最小的是_____;c(NH4+)最小的是____(填序号)。
(3)在溶液④中,_____________离子的浓度为0.1mol/L;NH3H2O和________离子的物质的量浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____________c(NH4+)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
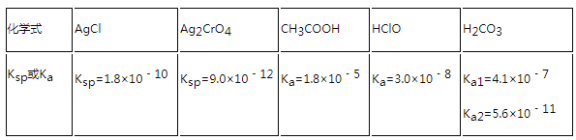
A.相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO﹣+CO2+H2O=CO32﹣+2HClO
C.向0.1 molL﹣1CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO﹣)=5:9,此时溶液的pH=5
D.向浓度均为1.0×10﹣3molL﹣1的KCl和K2CrO4混合溶液中滴加1.0×10﹣3molL﹣1的AgNO3溶液,CrO42﹣先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000 mL溶液。除了烧杯外,还需要的玻璃仪器有_____________ 、____________、和_____________。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_______________式滴定管。
②滴定时眼睛应________.
③有关数据记录如下:
测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.50 |
2 | 20.00 | 1.20 | 21.20 |
(3)计算纯度:烧碱样品的纯度是_______。
(4)误差分析(填“偏高”,“偏低”,或“无影响”)
a. 酸式滴定管用蒸馏水洗后未用标准液润洗,就直接装入标准液,造成测定结果____________。
b、锥形瓶水洗后,又用待测液润洗,,测定结果____________。
c、用碱式滴定管取待测液时,滴定管尖嘴处有气泡未排出就取液入锥形瓶,造成测定结果____________。
d、滴定前,锥形瓶用水洗涤后,锥形瓶中残留水未干燥,造成最终结果___。
e、酸式滴定管,滴定前仰视读数,滴定后平视读数,造成测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)c(SO42﹣),所以在BaSO4溶液中有c(Ba2+)=c(SO42﹣)=![]()
③将0.1molL﹣1的NaHS和0.1molL﹣1Na2S溶液等体积混合,所得溶液中有c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S)
④在0.1mol/L氨水中滴加0.1mol/L盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10﹣a molL﹣1
A.①④B.②③C.③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应: ,但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350 K和470 K,经过足够长时间后,右端的主要物质是
,但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350 K和470 K,经过足够长时间后,右端的主要物质是

A. 纯Ni(s)和Ni(CO)4(g) B. 纯Ni(s)和CO(g)
C. 不纯Ni(s)和CO(g) D. 不纯Ni(s)和Ni(CO)4(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
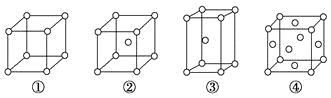
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1) A元素基态原子占据最高能级的电子云轮廓图为_________;B元素原子中未成对电子为_________,E元素原子核外由_________种运动状态不同的电子。
(2)写出C元素基态原子的电子排布式:_____________________。
(3)D元素的价层电子排布图为:_________________________。
(4)元素B与D的电负性的大小关系是B____________(填“>”“<”或“=”,下同)D,E与C的第一电离能大小关系是E________C。
(5)写出元素C的单质和元素E的最高价氧化物的水化物的水溶液反应的离子方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com