
【题目】按要求分别用双线桥或单线桥标出下列反应中电子转移的情况。
①2Na+Cl2![]() 2NaCl(双线桥)____________。
2NaCl(双线桥)____________。
②MnO2 +4HCl(浓)![]() MnCl2+Cl2↑+2H2O(双线桥)__________。
MnCl2+Cl2↑+2H2O(双线桥)__________。
③Fe+CuSO4=Cu+FeSO4(单线桥)___________
【答案】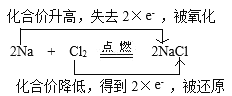

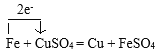
【解析】
在用双线桥法表示时,根据在反应中,元素化合价升高,失去电子,被氧化;元素化合价降低,获得电子,被还原,在桥上注明元素化合价的升降、电子的得失及反应类型;
在单线桥法表示时,箭头从反应物中失去电子的元素指向反应物中获得电子的元素,桥上只注明电子转移数目。
①在2Na+Cl2![]() 2NaCl反应中,Cl元素化合价由反应前Cl2单质的0价变为反应后NaCl的-1价,化合价降低,获得2×1e-电子,被还原;Na元素化合价由反应前Na单质的0价变为反应后NaCl的+1价,化合价升高,失去2×1e-电子,被氧化,用双线桥法表示为:
2NaCl反应中,Cl元素化合价由反应前Cl2单质的0价变为反应后NaCl的-1价,化合价降低,获得2×1e-电子,被还原;Na元素化合价由反应前Na单质的0价变为反应后NaCl的+1价,化合价升高,失去2×1e-电子,被氧化,用双线桥法表示为: ;
;
②在MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O反应中,Cl元素化合价由反应前HCl中的-1价变为反应后Cl2的0价,化合价升高,失去2×1e-电子,被氧化;Mn元素化合价由反应前MnO2中的+4价变为反应后MnCl2的+2价,化合价降低,获得2×1e-电子,被还原,用双线桥法表示为:
MnCl2+Cl2↑+2H2O反应中,Cl元素化合价由反应前HCl中的-1价变为反应后Cl2的0价,化合价升高,失去2×1e-电子,被氧化;Mn元素化合价由反应前MnO2中的+4价变为反应后MnCl2的+2价,化合价降低,获得2×1e-电子,被还原,用双线桥法表示为: ;
;
③在Fe+CuSO4=Cu+FeSO4反应中,Fe元素化合价由反应前Fe单质的0价变为反应后FeSO4中的+2价,化合价升高,失去2e-电子,被氧化;Cu元素化合价由反应前CuSO4中的+2价变为反应后Cu单质的0价,化合价降低,获得2e-电子,被还原,用单线桥法表示为: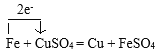 。
。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】温度为T时,在两个起始容积都为1 L的恒温密闭容器发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH<0。实验测得:v正=2v(H2)消耗=2v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:v正=2v(H2)消耗=2v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A. 反应过程中,容器Ⅰ与容器Ⅱ中的物质的量比为1∶3
B. 两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C. 温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=k正/k逆成立
D. 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素( )是一种治疗胆结石的药物,下列说法正确的是
)是一种治疗胆结石的药物,下列说法正确的是
A. 分子中的两个苯环都可以发生加成反应
B. 二氯代物超过两种
C. 1mol羟甲香豆素与氢气加成,最多需要5molH2
D. 所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是
A.  所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
B.  所示装置验证二氧化硫的漂白性
所示装置验证二氧化硫的漂白性
C.  所示装置分离四氯化碳和苯的混合物
所示装置分离四氯化碳和苯的混合物
D.  所示装置检验氯化铵受热分解生成的两种气体
所示装置检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为常温下向10mL0.1 mol·L-1 NH3·H2O中加入等浓度的盐酸时,NH3·H2O的物质的量随V(盐酸)的变化曲线。(电离度为已电离的NH3H2O占初始时NH3H2O的百分比),下列说法正确的是( )

A. 测得a点时溶液的pH=11,则NH3·H2O的电离度为1%
B. b点时溶液的pH=7
C. 水的电离程度:b<c
D. c点时溶液中存在关系式:2c(Cl-)=c(NH4+) +c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,图①是细胞中化合物含量的扇形图,图②是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )


A.若图①表示正常细胞中化合物含量的扇形图,则甲、乙化合物共有的元素中含量最多的是a
B.若图①表示细胞完全脱水后化合物含量的扇形图,则甲化合物是生命活动的主要承担者
C.图②中含量最多的元素a与正常情况下细胞中含量最多的化合物无关
D.若图①表示正常细胞中化合物含量扇形图,则乙化合物具有多样性,其必含的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液叙述错误的是
A. 某H2SO4溶液中c(OH-)/c(H+)=1.0×10-8,由水电离出的c(H+)=1×10-11mol·L-1
B. 将0.02mol·L-1盐酸与0.02mol·L-1Ba(OH)2溶液等体积混合后溶液pH约为12
C. 将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH一定大于7
D. 向0.1mol·L-1Na2CO3溶液中逐滴滴加0.1mol·L-1稀盐酸,溶液中c(HCO)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某锂离子电池工作原理如下图所示,电池反应为:Li1-xCoO2+LixC![]() LiCoO2+C。下列说法不正确的是
LiCoO2+C。下列说法不正确的是

A. 放电时,电子从b极经用电器流向a极
B. 放电时,若转移1mol e-,碳材料将增重7 g
C. 充电时,锂离子通过隔膜进入右室
D. 充电时,a极反应:LiCoO2-xe-= Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在恒容密闭容器中反应,达到平衡状态的标志是①单位时间内生成n molO2 的同时消耗 2n mol NO;②单位时间内消耗2n molNO2的同时生成n molO2;③混合气体的颜色不再改变的状态;④2v(NO2)正= v(O2)逆;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体的密度不再改变的状态
2NO(g)+O2(g)在恒容密闭容器中反应,达到平衡状态的标志是①单位时间内生成n molO2 的同时消耗 2n mol NO;②单位时间内消耗2n molNO2的同时生成n molO2;③混合气体的颜色不再改变的状态;④2v(NO2)正= v(O2)逆;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体的密度不再改变的状态
A. ①③⑤ B. ②④⑥ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com